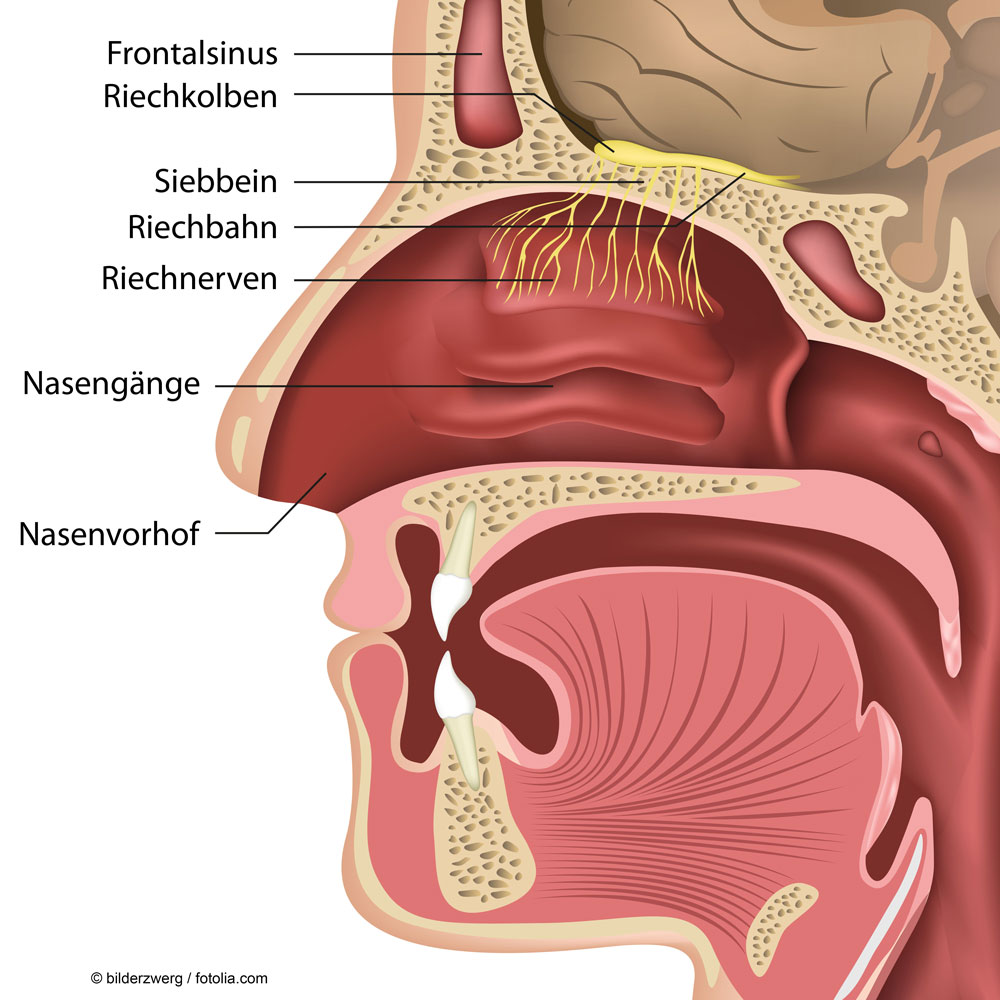
Die Riechschleimhaut ist ein Gewebe, das sich bei Säugetieren also auch beim Menschen in der Nase befindet, besser gesagt dem oberen Teil der Nasenmuschel, dem Nasendach. Hier strömt die eingeatmete Luft an freien Nervenendigungen vorbei. Alles was dort in die Nervenzellen hineingelangt, kann unter Umständen auch direkt zum Riechkolben und von dort direkt ins Vorderhirn gelangen, ohne dass die Blut-Hirn-Schranke passiert werden muss.
Am Anfang unseres Atemtraktes sitzt die Nase, die verschiedene Funktionen hat: sie wärmt die Atemluft bei kalten Aussentemperaturen an, sie filtert grobe Schmutzpartikel durch Härchen aus der Atemluft und sie feuchtet die Atemluft an, so dass unsere Lungen nicht zu sehr abkühlen, nicht mit Schmutz überfrachtet oder ausgetrocknet werden. Unsere Atemluft enthält eine Vielzahl von Molekülen, Staubpartikeln und biologische Bestandteile (Pollen, Bakterien, Viren, Pflanzenfasern etc.). Neben Gasmolekülen wie dem Sauerstoff, der für uns sehr wichtig ist, kommen so auch ungewollt andere Dinge in unseren Atemtrakt. Gelangen diese tief in die Lunge, so kommen sie mit der Blut-Luft-Schranke in Kontakt. Aber schon vorher, ganz oben in unserem Atemtrakt, haben Moleküle und Partikel die Möglichkeit, eine weitere Funktion in der Nase auszulösen, das Riechen!
Die Riechschleimhaut – Kurzschluss zum Gehirn
In unserer Nase befindet sich oben im Nasendach eine Region, die Riechschleimhaut (wissenschaftlich: Riechepithel) genannt wird. Diese Riechschleimhaut enthält beim Menschen ca. 5 Millionen Riechzellen und ist ca. 5 cm2 groß (zum Vergleich: diese Fläche ist beim Hund ca. 150 cm2 groß und der Hund besitzt ca. 125 bis 220 Millionen Riechzellen!). Hier binden Gasmoleküle an freie Nervenendigungen von sensorischen Riechnerven (sog. Riechzellen), was zu deren Aktivierung führt und die Mischung der Reize gibt uns eine Sinneswahrnehmung unserer Umwelt, die wir Geruch nennen. Der Mensch ist aufgrund der geringen Anzahl der Nervenzellen nicht sehr empfindlich, aber immerhin können wir angenehme und unangenehme Gerüche ausreichend gut unterscheiden. Die Riechzellen sind Nervenzellen, die mit ihrem Zellkörper und seinen Fortsätzen, den Riechbahnen, das Nasendach durchdringen und direkt mit dem Riechkolben im Gehirn verbunden sind. Der Riechkolben ist ein Bündel weiterer Nervenzellen, die alle Signale der sensorischen Zellen weiterleiten, damit diese im Vorderhirn zu Sinneseindrücken verarbeitet werden können. Durch die besondere „Verschaltung“ der sensorischen Riechzellen ist es nun tatsächlich möglich, dass Moleküle oder auch kleine Partikel, die unter bestimmten Umständen in die Nervenzellen aufgenommen werden, sich in diesen weiterbewegen können und damit ohne die Blut-Hirn-Schranke überwinden zu müssen direkt ins Vorderhirn gelangen. Diese direkte Abkürzung ins Gehirn stellt daher ein gewisses Risiko dar, wenn wir umweltrelevante Belastungen oder die Exposition gegenüber Nanopartikeln betrachten.
Umweltbelastung und die Nase
Tatsächlich kamen die ersten Hinweise auf einen Zusammenhang zwischen der Umweltbelastung durch Feinstaub und dem Nachweis solcher Umweltschadstoffe im Vorderhirn erst zu Beginn dieses Jahrtausends auf. Gezeigt wurde dies in einer hoch-belasteten Umgebung: Mexiko City lag in den 90er Jahren des letzten Jahrhunderts mit 70 bis 270 µg/m3 regelmäßig weit über den üblichen Grenzwerten für Feinstaub und damit sind Menschen und Tier dauerhaft belastet [1]. Zum Vergleich: der in Europa erlaubte Höchstwert für den Jahresmittelwert liegt bei max. 50 µg/m3! Die Wissenschaftlerin Lilian Calderon-Garciduenas hat mit ihrem Team sowohl Hunde als auch Kinder untersucht [2-8]. Dabei wurde neben den gesamten Atemwegen auch das Gewebe der Nase als auch die abführenden Nervenzellen und das Gehirn unter anderem von Unfallopfern (Hunde und Kinder, die ihr gesamtes Leben in der Innenstadt von Mexiko City verbracht hatten) untersucht [6-8]. Die Studien ergaben einen direkten Zusammenhang zwischen der Umweltbelastung und adversen Effekten in den Atemwegen, meist Entzündungsprozesse.
Es konnte aber auch eine Belastung des Riechkolbens und des Vorderhirns mit den entsprechenden Partikeln beobachtet werden. Allerdings müssen hier auch einige Einschränkungen gemacht werden, wenn wir die Partikel betrachten und auf Nanopartikel Rückschlüsse ziehen wollen. Zum einen ist die Umwelt in Mexiko nicht nur mit Partikeln belastet, sondern es kommen auch andere Schadstoffe wie Ozon und verschiedene Chemikalien in der Luft vor, die ebenfalls zu Gewebeschädigung führen. Daher kann in dieser Umgebung eine Belastung des Vorderhirns nicht einfach auf einen Transport der Partikel zurückgeführt werden, sondern es muss auch eine Gewebsschädigung der Riechschleimhaut durch schädliche Gase und andere chemische Substanzen in Betracht gezogen werden. Dies trifft auch für die Untersuchung von anderen Kindern, Jugendlichen und Erwachsenen zu. Es wurde auch hier eine Belastung des Vorderhirns mit den in der Umwelt gefundenen Partikeln festgestellt, aber ebenfalls war eine direkte Schädigung des nasalen Gewebes auch im Bereich der Riechschleimhaut zu beobachten [9]. Eine solche Gewebsschädigung erleichtert natürlich einen direkten Transport von Umweltschadstoffen und Partikeln sehr. Generell lassen diese Studien den Schluss zu, dass eine hohe dauerhafte Umweltbelastung der Luft zu einer Schädigung der Gewebe des Atemtraktes führen, sowohl der oberen als auch der unteren Atemwege, und dies führt in den oberen Atemwegen zu einer direkten Belastung des Vorderhirns.
Nanopartikel und der Riechkolben
Die Studien von Lilian Calderon-Garciduenas haben sowohl Anregung zu weiteren Überlegungen gegeben als auch weitere Studien von Wissenschaftlern in aller Welt angestoßen. Gleich mehrere Studien haben im Jahr 2002 den kurzen Weg in das Vorderhirn untersucht. Dabei wurden u.a. Manganphosphatpartikel [10] bzw. Kohlenstoffpartikel [11] untersucht. Die untersuchten Partikel waren radioaktiv markiert, so dass diese im Gewebe der Versuchstiere gut wieder zu finden waren. Sowohl Mikrometer große Partikel (Manganphosphat) als auch Nanopartikel (Kohlenstoff) konnten nach Inhalationsversuchen in der Riechschleimhaut und den abführenden Nerven (Riechkolben) nachgewiesen werden. Eine neuere Studie mit radioaktiv markierten Iridium-Partikeln machte deutlich, dass es einen klaren Unterschied gibt, über welchen Weg die Partikel in das Gehirn kommen [12]. Während die Beatmung in die tiefen Atemwege (Lunge) zu keiner nennenswerten Belastung des Gehirns führten (es waren zwar einige Partikel nachweisbar, aber nur sehr wenige haben die Blut-Hirn-Schranke überschreiten können), wurden bei der Nasenatmung deutlich mehr Partikel im Gehirn gefunden. Diese sind offensichtlich über den Riechnerv dorthin gelangt. Jedoch sind auch über diesen Weg insgesamt relativ wenige Partikel in das Gehirn eingedrungen, aber eine dauerhafte Belastung mit Partikeln in der Atemluft über das „normale“ Maß hinaus sollte man aus diesem Grund möglichst vermeiden.
Die Studien zeigen, dass es tatsächlich eine Abkürzung für Schadstoffe und Partikel über die Riechschleimhaut zum Gehirn gibt. Allerdings müssen für eine gesundheitliche Beeinträchtigung über diesen Pfad die Konzentrationen vor allem für Partikel zum einen sehr hoch sein und zum anderen eine Exposition über eine längere Zeit erfolgen. Die Europäische Gesetzgebung hat dies bereits in die aktuellen Grenzwerte für Feinstaub und andere Luftschadstoffe mit einbezogen.
Literatur
- Chow, JC et al. (2002), Sci Total Environ 287 (3): 177-201
- Calderon-Garciduenas, L et al. (2000) Med Hypotheses 55 (5): 373-378
- Calderon-Garciduenas, L et al. (2001a) Toxicol Sci 61(2): 342-355
- Calderon-Garciduenas, L et al. (2001b) Toxicol Sci 61(2): 356-67
- Calderon-Garciduenas, L et al. (2003) Pediatr Pulmonol 36(2): 148-61
- Calderon-Garciduenas, L et al. (2003) Toxicol Pathol 31(5):524-38
- Peters, A et al. (2006) Part Fibre Toxicol 3: 13
- Calderon-Garciduenas, L et al. (2002) Toxicol Pathol 30(3): 373-89
- Calderon-Garciduenas, L et al. (2013) Exp Toxicol Pathol 65: 503-511
- Dorman, DC et al. (2002) J Toxicol Environ Health A 65(20): 1493-511
- Oberdörster, G et al. (2004) Inhal Toxicol 16(6-7): 437-445
- Kreyling, WG (2016) Toxicol Appl Pharmacol 299: 41-46
 >
>