Medizinprodukte sind aus dem Gesundheitsbereich nicht wegzudenken und stellen einen enormen Markt dar. Ihre Anwendungen reichen von medizinischen Geräten über Diagnosemöglichkeiten einschl. Software bis hin zu Implantaten, Spritzen und mechanischen Verhütungsmitteln. Beim Einsatz am und im menschlichen Körper muss die Verträglichkeit der Produkte gewährleistet sein. Hier bieten innovative Materialien neue, vorteilhafte Eigenschaften, wie z.B. höhere Festigkeiten und bessere Verträglichkeit. Die Nanotechnologie trägt zu neuen Produktgenerationen bei, z.B. durch Veränderungen der Produktoberfläche mit Nanomaterialien, um die Verträglichkeit oder physikalisch-chemischen Eigenschaften zu verbessern.
Was sind Medizinprodukte?
Medizinprodukte grenzen sich klar von Arzneimitteln bzw. Medikamenten ab, da Medizinprodukte laut Gesetz keine pharmakologische (Medikamente betreffend) oder immunologische (das Immunsystem betreffend) Wirkung haben dürfen. Sie dürfen auch nicht durch im Körper erworbene Veränderungen (Metabolismus) aktiv werden.
Medizinprodukte sind in der europäischen Medizinprodukteverordnung und im Medizinprodukterecht-Durchführungsgesetz (MPDG) klar geregelt.
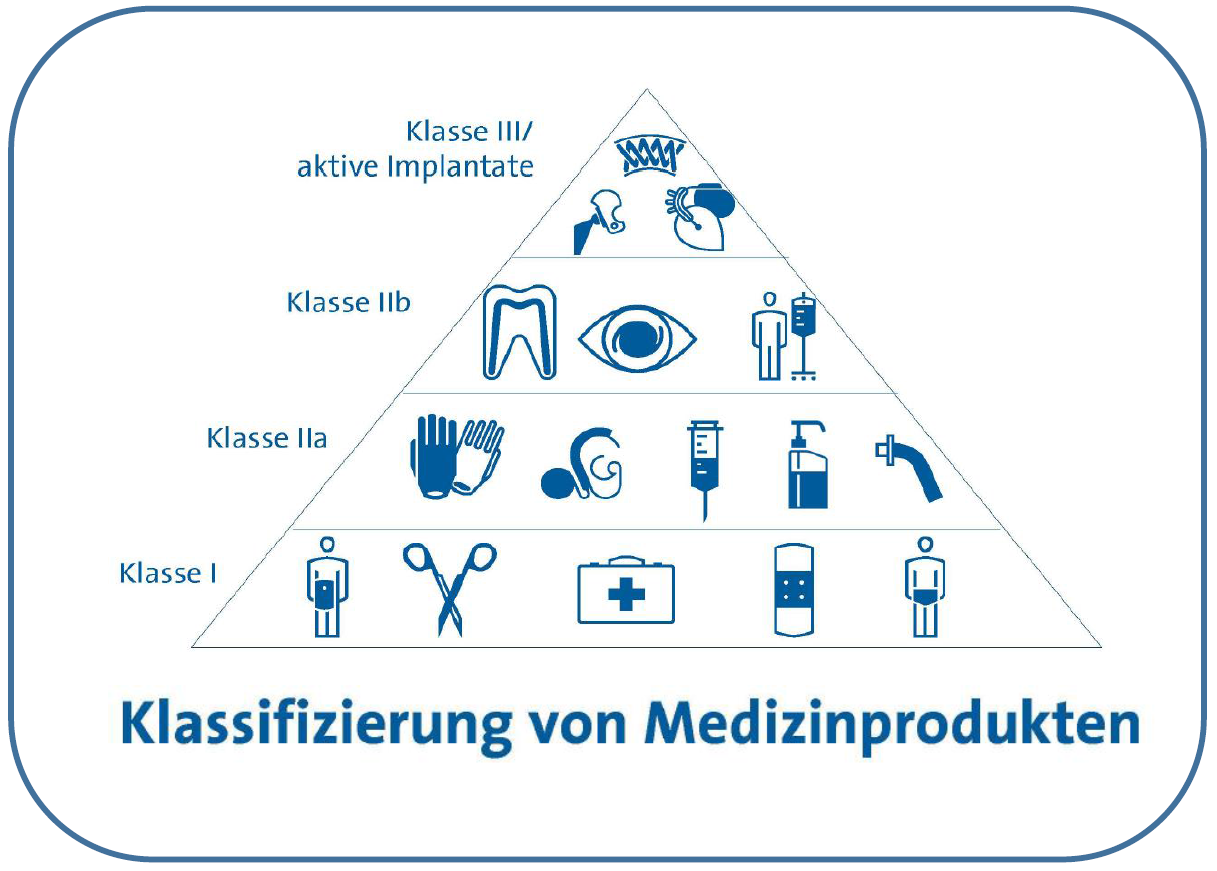
Klassifizierung von Medizinprodukten (Quelle BVMed)
Medizinprodukte können sowohl sehr klein als auch recht groß sein (von Nanopartikeln über Herzklappen bis zu Gelenkimplantaten oder einer Herz-Lungen-Maschine). Unabhängig von der Größe muss die Verträglichkeit über die gesamte Lebensdauer im Körper gewährleistet sein, das können mehrere Jahrzehnte sein.
Daher spielen sowohl ihre Standfestigkeit als auch die Sicherheit der verwendeten Materialien eine große Rolle. Für die Sicherheitsbeurteilung werden die Medizinprodukte in unterschiedliche Kategorien eingeteilt:
- Nicht-invasive Anwendungen, z.B. solche Produkte, die außen mit der Haut in Kontakt kommen können (Stethoskop, mechanische Verhütungsmittel u.a.m.)
- Invasive Anwendungen (Maßnahmen, die in den Körper eindringen, sowohl durch Operation als auch nicht) wie folgende:
- Material für die Wundversorgung
- Implantierbare Produkte
- Zahn- und Knochenersatz
- Injizierbares Material
Innovative Materialien in Medizinprodukten
Innovative Materialien sind aus dem Bereich der Medizinprodukte nicht mehr wegzudenken. So sind die winzigen Batterien (z.B. für Herzschrittmacher) oder Schaltkreise und Sensoren wegen der reduzierten Größe häufig nur mit Nanomaterialien umsetzbar. Neue Keramiken für Zahnfüllungen oder Schrauben für Zahnimplantate bestehen z.B. aus gesinterten oder aufgeschmolzenen und wieder erstarrten Mikro- oder Nanopulvern (ähnlich dem 3D-Druck), anderen innovativen Materialien wie speziell angepassten Polymeren oder sie besitzen speziell behandelte Oberflächen, sogenannte Nanostrukturen.
Innovative Materialien
 Mittlerweile kann eine Vielzahl innovativer Materialien in der Medizintechnik eingesetzt werden. Hier kann nur ein Ausschnitt gezeigt werden. Speziell für medizinische Anwendungen werden viele neue und aussichtsreiche Materialien entwickelt, denn einerseits gibt es für viele Krankheiten noch keine optimierten Behandlungsmethoden und andererseits lockt die Perspektive auf gute Umsätze.
Mittlerweile kann eine Vielzahl innovativer Materialien in der Medizintechnik eingesetzt werden. Hier kann nur ein Ausschnitt gezeigt werden. Speziell für medizinische Anwendungen werden viele neue und aussichtsreiche Materialien entwickelt, denn einerseits gibt es für viele Krankheiten noch keine optimierten Behandlungsmethoden und andererseits lockt die Perspektive auf gute Umsätze.
Die vom BMBF geförderte Initiative ProMatLeben-Polymere stellt auf ihrer Webseite https://promatleben.de/ seit 2018 verschiedene innovative Materialien für die Medizintechnik vor. Das Forschungsfeld umfasst hier beispielsweise neue mit Wirkstoffen gefüllte Polymere, polymere Implantat-Materialien sowie Beschichtungen für Implantate. Innovative Materialien, die Wirkstoffe einschließen und damit im Körper transportierbar machen, nennen sich in der Fachsprache „Carrier“, sie werden ebenfalls auf der Website erklärt.
Ein häufig verwendetes innovatives Material für Implantate ist Titan. Entweder als reines Metall oder in Form von Legierungen mit anderen Elementen wie Aluminium, Vanadium, Nickel, Niob, Molybdän [1]. Solche Implantate sind im menschlichen (und ggf. auch im tierischen) Körper immer dann hilfreich, wenn es gilt, Strukturen wiederherzustellen und zu stabilisieren.
Anwendungen dieser Titanmaterialien reichen von Ohrimplantaten zur Verbesserung der Schallleitung [2] über die Rekonstruktion der Augenhöhle bei Augenhöhlenfrakturen [3], Zahnimplantaten [1], Wirbelsäulenimplantaten [4], Beckenstabilisationen [5] und Stabilisierungen gebrochener Gliedmaßen bis hin zu Fußkorrekturen [6]. Hier sind Titan und Titanlegierungen wegen ihrer hohen Festigkeit sehr geschätzt. Hinzu kommt, dass die Oberfläche der Titanimplantate mit einer mikrometerdicken Titandioxidschicht überzogen sind, die vom menschlichen Körper nicht als körperfremd eingestuft und deshalb nicht abgestoßen wird [6].
Um unnötige Folgeoperationen zu vermeiden, werden häufig auch bioabbaubare Materialien eingesetzt. Hierzu eignen sich im Falle kleinerer Implantate bestimmte Kunststoffe aber auch Magnesium. Sie können von körpereigenen Enzymen abgebaut und resorbiert werden [7].
Andere Materialien wie z.B. Cobalt-Chrom Legierungen verschaffen Implantaten eine noch höhere Festigkeit. Allerdings können solche Alternativen zu Titanlegierungen auch Nachteile mit sich bringen, wie z.B. ein höheres Allergiepotential der Cobalt-Chrom-Legierungen [8]. Auf der anderen Seite besitzen gerade Kunststoffe eine deutlich geringere Festigkeit. Deshalb haben Titanimplantate einen hohen Marktanteil erlangt.
In jüngerer Zeit haben sich auch weitere Formteile, die auf Grund ihrer neuartigen Herstellung als innovativ bezeichnet werden müssen, zu den Titanmaterialien hinzugesellt: mit Hilfe von Elektronenstrahlschmelzen hergestellte 3D-Drucke aus Titanlegierungen (Ti- 6Al-4V) [4] können als komplexe Strukturen hergestellt werden, die dann beispielweise als Käfige in Bandscheibenoperationen eingesetzt werden, um die Bandscheibe zu ersetzen.
Zurzeit werden Perowskite als Implantat-Materialien diskutiert: Calciumtitanat (CaTiO3) [9] [10] und Bariumtitanat sind interessante Materialien, die auch in Kombination mit Fluorapatit (der dem natürlichen Knochen weitgehend entspricht) [10] [11] oder auch Kunststoffen [12] eingesetzt werden können.
Nanomaterialien
Neben den Beispielen für „große“ Medizinprodukte gibt es auch sehr kleine. So sind Nanopartikel aus Eisenoxid ein zugelassenes Medizinprodukt zur physikalischen Behandlung von Tumoren (z.B. im Gehirn), die in den Tumor injiziert und durch ein Magnetfeld angeregt werden, um durch Überhitzung (Hyperthermie) den Tumor abzutöten [13].
Die erwähnten Eisenoxidpartikel sind aber nur ein Beispiel für die vielfältigen Anwendungsbereiche von Nanomaterialien auf diesem Gebiet. Auch wenn noch vieles in der Testphase ist, so gibt es verschiedene nanoskalige Materialien, die bereits eingesetzt werden. Für Knochenaufbau und Zahnersatz werden verschiedene keramische aber auch Kunststoffpartikel oder Kohlefasern im Nanometerbereich eingesetzt. Nanosilber wird bei Implantaten oder auch bei Kathedern auf den Oberflächen verwendet, damit es zu keinen bzw. reduzierten Entzündungen kommt, die natürlich nach einer Operation sehr kritisch sein können. Allerdings müssen nicht immer direkt Nanopartikel oder Nanomaterialien eingesetzt werden.
Nano- und Mikrostrukturen
Nano- oder mikrostrukturierte Oberflächen können für ein verbessertes Einwachsen von Implantaten in den Körper [14] oder für besseren Halt des Implantats sorgen. Egal ob es sich um eine Schraube in einem Knochen, ein Zahnimplantat im Kiefer oder ein komplettes Hüftgelenk handelt, es darf nie zu Entzündungen kommen und das eingesetzte Teil soll möglichst „lebenslang“ im Körper seine Aufgabe erfüllen. Auch die Oberflächen von Herzschrittmachern sollen und dürfen für das umliegende Gewebe nicht als Fremdkörper erkannt werden, damit es nicht zu ungewollten Abstoßungsreaktionen des Körpers kommt. Daher wird versucht, mit entsprechenden Beschichtungen und Strukturen im Mikro- oder Nanometerbereich, die Verträglichkeit zu verbessern und die Lebensdauer erheblich zu verlängern.

Einteilung Medizinprodukte nach Risikoklassen (Quelle BMG, Grafik AOK-Mediendienst))
Rechtliche Grundlagen für die Sicherheit von Medizinprodukten
Die rechtlich verbindlichen Grundlagen für alle Medizinprodukte sind, wie oben bereits erwähnt, der europäischen Medizinprodukteverordnung und in dem zugehörigen Medizinprodukterecht-Durchführungsgesetz geregelt. Neben den oben beschriebenen Definitionen werden Medizinprodukte auch noch nach der Verweilzeit im oder am Körper in verschiedene Kategorien eingeteilt. Dabei wird zwischen kurzer (weniger als ein Tag), mittlerer (zwischen einem und 30 Tagen) und permanenter Verweilzeit (länger als 30 Tage) unterschieden. Diese und weitere wichtige Einteilungen hat das Komitee für neu identifizierte Gesundheitsrisiken der EU vorgenommen [15] und klare Vorgaben gemacht, wie und was gemessen werden muss, damit auch die Sicherheit derjenigen Medizinprodukte gewährleistet ist, wenn sie Nanomaterialien enthalten. In diesem Zusammenhang spielt die Testung auf biologische Effekte und toxikologische Reaktionen eine ganz besondere Rolle. Dazu sind in jüngster Zeit eine Reihe von Vorschlägen gemacht worden, wie und was gemessen werden soll [16] [17] [18]. Grundsätzlich sollen die Medizinprodukte natürlich keine Partikel in das umliegende Gewebe abgeben, aber dennoch muss auch für einen solchen Fall eine Teststrategie entwickelt werden. Dabei ist es manchmal auch unerheblich, ob bereits im Ausgangsprodukt Mikro- oder Nanopartikel enthalten sind oder nicht, denn auch durch mechanischen Abrieb, z.B. bei einem Gelenkimplantat, können solche sehr feinen Partikel entstehen und das sollte vorher getestet werden bzw. eine mögliche Gesundheitsgefährdung durch diese Partikel sollte möglichst ausgeschlossen sein.
Medizinprodukte sind ein weites und innovatives Feld für neue Materialien. Dabei spielen die Nanomaterialien eine wichtige Rolle in der Verbesserung der Funktionstüchtigkeit vieler Medizinprodukte, können aber auch für die Verträglichkeit relevant sein. Durch die Verwendung am und im menschlichen Körper müssen sie aber sehr hohe Anforderungen erfüllen, was ihre Sicherheit angeht.
Literatur
- Revathi, A., et al., Degradation mechanisms and future challenges of titanium and its alloys for dental implant applications in oral environment. Mater Sci Eng C Mater Biol Appl, 2017. 76: p. 1354-1368.
- Schwab, B., R. Salcher, and M. Teschner, Comparison of two different titanium couplers for an active middle ear implant. Otology & Neurotology, 2014. 35(9): p. 1615-1620.
- Yi, W.S., et al., Reconstruction of complex orbital fracture with titanium implants. Int J Ophthalmol, 2012. 5(4): p. 488-92.
- Zippelius, T., et al., Safety and efficacy of an electron beam melting technique-manufactured titanium mesh cage for lumbar interbody fusion. Orthopade, 2019. 48(2): p. 150-156.
- Sturesson, B., et al., Six-month outcomes from a randomized controlled trial of minimally invasive SI joint fusion with triangular titanium implants vs conservative management. European Spine Journal, 2017. 26(3): p. 708-719.
- Matthews, M., et al., Long-Term Outcomes of Corrective Osteotomies Using Porous Titanium Wedges for Flexible Flatfoot Deformity Correction. J Foot Ankle Surg, 2018. 57(5): p. 924-930.
- Konneker, S., et al., Comparison of SCAphoid fracture osteosynthesis by MAGnesium-based headless Herbert screws with titanium Herbert screws: protocol for the randomized controlled SCAMAG clinical trial. BMC Musculoskelet Disord, 2019. 20(1): p. 357.
- Grupp, T.M., et al., Modular titanium alloy neck adapter failures in hip replacement–failure mode analysis and influence of implant material. BMC Musculoskelet Disord, 2010. 11: p. 3.
- Cheng, H., et al., Calcium titanate micro-sheets scaffold for improved cell viability and osteogenesis. Chemical Engineering Journal, 2020. 389: p. 124400.
- Coreño, J. and O. Coreño, Evaluation of calcium titanate as apatite growth promoter. Journal of Biomedical Materials Research Part A, 2005. 75A(2): p. 478-484.
- Jianqing, F., Y. Huipin, and Z. Xingdong, Promotion of osteogenesis by a piezoelectric biological ceramic. Biomaterials, 1997. 18(23): p. 1531-1534.
- Bagchi, A., et al., Perovskite ceramic nanoparticles in polymer composites for augmenting bone tissue regeneration. Nanotechnology, 2014. 25(48): p. 485101.
- Maier-Hauff, K., et al., Efficacy and safety of intratumoral thermotherapy using magnetic iron-oxide nanoparticles combined with external beam radiotherapy on patients with recurrent glioblastoma multiforme. Journal of Neuro-Oncology, 2011. 103(2): p. 317-324.
- Bruinink, A., et al., Addition of nanoscaledbioinspiredsurface features: A revolution for bone related implants and scaffolds? Journal of Biomedical Materials Research Part A, 2014. 102(1): p. 275-294.
- Commission, E., D.-G.f. Health, and Consumers, Guidance on the determination of potential health effects of nanomaterials used in medical devices. 2015: European Commission.
- Gubala, V., et al., Engineered nanomaterials and human health: Part 1. Preparation, functionalization and characterization (IUPAC Technical Report). Pure and Applied Chemistry, 2018. 90(8): p. 1283-1324.
- Gubala, V., et al., Engineered nanomaterials and human health: Part 2. Applications and nanotoxicology (IUPAC Technical Report). Pure and Applied Chemistry, 2018. 90(8): p. 1325-1356.
- Myers, D.K., et al., From in vivo to in vitro: The medical device testing paradigm shift. ALTEX – Alternatives to animal experimentation, 2017. 34(4): p. 479-500.
 >
>