Nickel gehört zu den Schwermetallen. Wie viele andere sieht es silbrig glänzend aus. Nickel ist Bestandteil in Gebrauchsstählen, z.B. dem V2A Edelstahl und den Edelstahlsorten mit den Markennamen Nirosta und Cromargan, die für Essbesteck verwendet werden. Nickel spielt auch eine wichtige Rolle in den meisten modernen Batterien wie dem Lithium-Ionen-Akku oder den schon seit Jahren bekannten Nickel-Metallhydrid-Akkus.

Nickel on the periodic table of the elements. @natros_stock.adobe.com
Wie könnte ich damit in Kontakt kommen?
Nickel ist in zahlreichen Alltagsgegenständen zu finden, vom Essbesteck über Gitarrensaiten bis hin zu Batterien. Nickel steckte oft in Schmuck, Gürtelschnallen oder in Brillengestellen, weil sich deren silberglänzende Oberfläche durch Hautkontakt nicht ändert, also z.B. nicht anläuft. Durch den direkten Hautkontakt können diese Gegenstände allergische Hautreaktionen auslösen.
Arbeitende in der chemischen Industrie treffen bei Reaktoren, Kesseln, Armaturen und Rohrleitungen unter Umständen auf Nickel, je nach Einsatzzweck des jeweiligen technischen Materials.
Wie gefährlich ist das Material für Mensch und Umwelt?
Nickel ist relativ harmlos für Mensch und Tier, wenn es in Stahl gebunden vorliegt. Solche Stähle sind sehr stabil und haltbar. Sie setzen nur sehr wenig lösliches Nickel als Nickelsalze frei. Diese Nickelsalze sind erst in größerer Menge für Menschen giftig.
Für einige Bakterienarten ist Nickel in geringen Mengen lebenswichtig. Es erfüllt in deren Enzymen einen wichtigen Dienst – im Gegensatz zum Menschen, der Nickel für die Prozesse in seinem Körper nicht zu brauchen scheint, jedenfalls hat man bislang keinen Hinweis darauf gefunden.
Fazit
Nickel begegnet uns in vielen Gebrauchsgegenständen. Nickel kann allerdings eine Allergie auslösen. Die Nickelallergie ist eine der häufigsten Allergien in Deutschland.
Nebenbei
Das auf der Erde vorhandene Nickel stammt aus Sternen, die vor langer Zeit ausgebrannt sind. Die Sterne erzeugen das Nickel in den letzten Wochen vor dem Ende ihres Daseins und schleudern es dann in einer Supernovaexplosion ins Weltall.
Eigenschaften & Anwendungen
 Nickel ist ein silberglänzendes Metall, das wegen seiner hohen Dichte als Schwermetall bezeichnet wird. Es ist korrosionsbeständiger als andere Metalle und wird deshalb zur Verbesserung dieser Eigenschaft in vielen Legierungen eingesetzt. Auch als Oberflächenbeschichtung wird es umfassend in der Technik verwendet, normalerweise wird das Nickel galvanisch aufgetragen. Nickel- Cobalt-Mangan-Lithium-Mischoxide werden in Batterien (Akkumulatoren, Akkus) eingesetzt.
Nickel ist ein silberglänzendes Metall, das wegen seiner hohen Dichte als Schwermetall bezeichnet wird. Es ist korrosionsbeständiger als andere Metalle und wird deshalb zur Verbesserung dieser Eigenschaft in vielen Legierungen eingesetzt. Auch als Oberflächenbeschichtung wird es umfassend in der Technik verwendet, normalerweise wird das Nickel galvanisch aufgetragen. Nickel- Cobalt-Mangan-Lithium-Mischoxide werden in Batterien (Akkumulatoren, Akkus) eingesetzt.
Feinverteiltes Nickel kann selbstentzündlich sein (pyrophor), deshalb muss es als Nanopartikel unter Schutzgas aufbewahrt werden.
Nickel in Alltagsanwendungen
Nickel findet man in Form von Legierungen in Münzen (ein „Nickel“), Brillen und Modeschmuck (z.B. früher: Nickelbrille oder -armbanduhren, heute wegen Allergiegefahr eingeschränkt), Magneten (Alnico), Gitarrensaiten, Mikrofonkapseln, Armaturenbeschichtungen, zur Grünfärbung von Glas sowie in Keramikpigmenten.
Die angesichts der Energiewende derzeit wohl am meisten diskutierte Anwendung von Nickel ist in Kathodenmaterialien von Akkumulatoren zu finden. In den aktuellen Forschungsarbeiten werden Nickel und andere Metalle in Kürzeln wie NMC 6:2:2 versteckt, im Beispiel handelt es sich um ein Mischoxid aus Lithium, Nickel, Mangan und Cobalt, die Zahlen geben die Mengenverhältnisse der Metalle (ohne Lithium) an, also NMC 622 heißt, dass auf sechs Atome Nickel 2 Atome Mangan und 2 Atome Cobalt kommen. Gängige Verhältnisse sind, z.B.:
- NMC111: LiNi1/3Mn1/3Co1/3O2
- NMC622: LiNi0.6Mn0.2Co0.2O2
- NMC811: LiNi0.8Mn0.1Co0.1O2
Für die Batteriematerialien wird üblicherweise das sogenannte „Class 1 Nickel“ eingesetzt, das eine Reinheit von mehr als 99% hat . In der jüngeren Entwicklung wird auf erhöhte Nickelgehalte, also z.B. NMC811 in den Kathoden gesetzt, um die Abhängigkeit von Cobalt zu verringern.
Nickel wird vor allem zur Veredelung von Stahl eingesetzt. Der weltweit breit eingesetzte V2A-Edelstahl enthält 8% Nickel. Der V4A-Stahl mit 11% Nickelgehalt ist im Alltag besser unter den Markennamen Cromargan oder Nirosta bekannt.
In Essbestecken, die mit der Handelsbezeichnung „Neusilber“ gekennzeichnet sind, ist bis zu einem Viertel des Gewichts als Nickel zu finden. Es dient hier dazu, den Glanz des neuen Bestecks über lange Zeit aufrecht zu erhalten, weil das Nickel die Oberflächenkorrosion (Anlaufen) verhindert. Chirurgische Instrumente können ebenfalls mit aus mit Nickel legiertem Stahl bestehen.
Durch Vernickeln werden Gebrauchsgegenstände aus Stahl und anderen Metallen vor Korrosion geschützt. Das geschieht per Galvanisierung, einem elektrochemischen Verfahren.
Für Elektrogeräte, in denen besonders genaue Widerstände benötigt werden, die auch noch über einen größeren Temperaturbereich konstant bleiben müssen, wird Konstantan, eine Kupfer-Nickel-Legierung eingesetzt.
Nickel in der Industrie
Nickelhaltige Stähle (s.o.) und vernickelte Apparate, Armaturen und Gebrauchsgegenstände sind besonders im Labor und in der chemischen Industrie gängig (Nickelspatel). Dabei wird die erhöhte Korrosionsbeständigkeit des Nickels ausgenutzt.
Monel Metall ist eine weitere Nickellegierung aus Nickel, Kupfer und Eisen, deren besondere Beständigkeit gegen Fluorgas bei der Gasflaschenherstellung eingesetzt wird.
Für hochbeanspruchte Maschinenteile werden sog. Nickelbasis Superlegierungen eingesetzt, die auch den Belastungen in Flugzeugturbinen und Gasturbinen standhalten.
Nickel wird in einer großen Zahl katalytischer Prozesse eingesetzt, es ist eines der wichtigsten Katalysatormaterialien in der Chemischen Industrie . Raney-Nickel ist eine Nickel-Aluminium-Legierung, die zur katalytischen Hydrierung von organischen Verbindungen mit Wasserstoff eingesetzt wird. Eine praktische Anwendung von Raney-Nickel und anderen nickelbasierten katalytischen Verfahren, die auch den heimischen Esstisch erreicht, ist die Hydrierung von ungesättigten Fettsäuren in Pflanzenölen bei der Margarineherstellung, die sogenannte Fetthärtung. Sie ist notwendig, weil Pflanzenöle zwar relativ preisgünstig und mit geringem CO2-Fußabdruck hergestellt werden, sich aber aufgrund ihrer flüssigen Form nicht als Butterersatz eignen. Die Herausforderung bei der Fetthärtung besteht darin, möglichst wenige trans-Fettsäuren zu erzeugen, die als Nebenprodukt entstehen. Sie gelten als Mitverursacher von Herz-Kreislauferkrankungen – im Gegensatz zu den in Pflanzenfetten natürlich vorkommenden cis-Fettsäuren.
Nickelverbindungen werden, oft zusammen mit anderen Komponenten, als Wasserstoffspeichermaterialien erforscht, unter anderem mit oder als Metallhydride (beispielsweise als Nano-Katalysator mit Zinkboranat (Zn(BH4)2) oder Magnesiumhydrid (MgH2) oder als nickelhaltige Wasserstoffverbindung Nickel Aluminiumhydrid (NiAlH4) .
Natürliches Vorkommen von Nickel
Nickelerze, also mineralische Vorkommen von Nickel, die industriell ausgebeutet werden, gibt es in Indonesien (33,6% der Weltproduktion im Jahr 2019), auf den Philippinen (12,7%), in Neukaledonien (8,3%), Kanada (7,4%), Australien (6,3%) und weiteren Ländern . Dort wird es bergmännisch abgebaut, oft im Tagebau, was massive Landschaftsbeeinträchtigungen verursacht. Wird Nickel im Untertagebau gewonnen, sind die Auswirkungen auf die Landschaft geringer, allerdings muss der Abraum (also das Gestein, das beim Ausgraben des Nickelerzes anfällt, selbst aber kein oder zu wenig Nickel enthält, um es weiterzuverarbeiten) untergebracht werden.
Die wichtigsten Mineralien, die abbauwürdige Nickelgehalte aufweisen, sind Pentlandit (der auch Nickelmagnetkies genannt wird) sowie verschiedene Silikatminerale mit unterschiedlichem Nickelgehalt wie Garnierit, Népouit, Nontronit und nickelführender Goethit. Diese Minerale enthalten neben Nickel auch andere Elemente wie Eisen .
Neben den Vorkommen von Nickel, die zur Herstellung des Metalls dienen, ist Nickel auch in Spuren in Pflanzen und Tieren vorhanden. In verschiedenen Pflanzen und Mikroorganismen spielt Nickel in Enzymen (z.B. in Ureasen, Co-F430) eine wichtige Rolle. Bei Säugetieren konnten jedoch bisher keine Hinweise auf nickelhaltigen Enzyme gefunden werden .
Herstellung von Nickel
Nickelmetall wird aus Erzen gewonnen. Diese enthalten neben Nickel oft Eisen und Kupfer. Bei der Nickelgewinnung wird Eisen als unerwünschter Bestandteil in Form von Eisenoxid oder -silikatschlacke über Verhüttungsverfahren abgetrennt. Dabei entsteht Kupfer-Nickel-Feinstein. Neben dem Nickel enthält er auch Kupfer, das wegen seines relativ großen Werts nicht weggeworfen wird. Die beiden Metalle werden stattdessen durch ein weiteres Hochtemperaturverfahren voneinander getrennt und jeweils weiterverarbeitet, wobei Rohnickel entsteht. Es wird in der Stahlproduktion direkt eingesetzt. Das Rohnickel wird nachfolgend durch Elektrolyse zu Reinnickel mit einer üblichen Reinheit von > 99.8% raffiniert, das bereits für viele Anwendungen, z.B. Batterien geeignet ist. Wenn noch reineres Nickel benötigt wird, kann das Reinnickel durch das Mond-Verfahren zu Reinstnickel gereinigt werden. Es besteht dann zu mehr als 99,99% aus Nickel.
Zur Herstellung von Nickel Nanopartikeln werden üblicherweise Nickelverbindungen der Oxidationsstufe +2 kontrolliert zum Nickel-Metall reduziert. Damit sich die Nickel Nanopartikel nach Ihrer Bildung nicht gleich wieder zu größeren Aggregaten zusammenlagern, wird ein Tensid, also eine Art Seife zugesetzt, die durch ihre Anlagerung an die Oberfläche der Nanopartikel das Zusammenlagern verhindert .
Gewinnung
Nickel wird sowohl im Tagebau als auch im Tiefbau gewonnen. Die Hauptförderländer sind Indonesien, die Philippinen und Russland (siehe dazu auch: https://de.statista.com/statistik/daten/studie/37062/umfrage/produktion-von-nickel-weltweit-nach-laendern/). Der weltweite Nickelbedarf für Edelstahl und Batterien, in denen das Element in Kathoden von Lithium-Ionen-Akkus eingesetzt wird, steigt ständig. Neben der klassischen Gewinnung aus Erzen an Land ist daher in Zukunft die Gewinnung aus Manganknollen geplant, die neben Mangan und Nickel häufig auch Kupfer, Kobalt, Gold und Silber enthalten. Manganknollen befinden sind in verschiedenen Gebieten am Meeresgrund und ihre Förderung würde ein sensibles und in weiten Teilen unerforschtes Ökosystem zerstören.

Gesteinsbrocken aus Nickelerz. @Adwo-stock.adobe.com
Der Abbau an Land ist mit Umweltauswirkungen durch Landverbrauch verbunden, besonders im Tagebau. Im Vergleich zu anderen Metallen entsteht bei der Nickelförderung wenig Abraum, weil ein Teil der Schlacke als Rohstoff im Straßenbau verwendet werden kann. Das ist positiv zu bewerten, da keine Flächen für die Lagerung des Abraums benötigt werden.
Ressourcenverbrauch bei Aufbereitung
Für die Nickelgewinnung werden durch den Verlust von Waldgebieten und damit verbunden der Biodiversität natürliche Ressourcen verbraucht. Je nach Ausgangsmineral ist der Energieverbrauch bei der Verhüttung zum Teil sehr hoch.
Sicherheit
Nickel kann beim Menschen eine Kontaktallergie auslösen, weshalb die Verwendung in Schmuck, Spielzeug, Besteck und Töpfen etc. gesetzlich reduziert wurde. Das Einatmen von Nickel-haltigem Staub mit Nickelpartikeln, die kleiner als 1 mm sind, kann beim Menschen Lungenkarzinome auslösen, was insbesondere für den Arbeitsschutz relevant ist. Nickelverbindungen und Nickelsalze weisen teilweise eine höhere Giftigkeit auf als reines Nickel. Für aquatische Organismen wie Wasserflöhe und Fische ist Nickel in feiner Pulverform ebenfalls toxisch, während es für Pflanzen ein essentielles Element ist.
Emissionen
Beim Nickelabbau entsteht Schlamm, welcher häufig durch technisch unzulängliche Dämme („Schlammteiche“) zurückgehalten wird. Hier gab es in der Vergangenheit viele Unfälle durch Leckagen. Beim Tiefbau entsteht Grubenwasser, welches Säuren und Schwermetalle enthalten kann. Pro Tonne gefördertes Nickel entstehen während der Verhüttung 10-50 Tonnen Schlacke, wovon ein Teil als Baurohstoff im Straßenbau verwendet wird. Bei der Nickelverhüttung wurden früher große Mengen an SO2 freigesetzt, die zum sogenannten „Sauren Regen“ beitrugen. Durch Filteranlagen wird SO2 heute nicht mehr freigesetzt. In der Umgebung einiger Abbaustätten beeinträchtigt schwermetallhaltiger Staub die Vegetation.
Je nach Ausgangsmaterial werden pro kg Nickelprodukt 13-45 kg CO2 emittiert, davon 68-87% während der Verhüttung, die restlichen 13-32% für Bergbau, Aufbereitung und Transport.
Soziale Aspekte
An einigen Abbaustätten für Nickel gibt es Landnutzungskonflikte mit der indigenen Bevölkerung. Laut dem Worldwide Governance Indicator stammen 76% des Nickels aus Ländern mit mittlerer bis schwacher Governance.
Die Wertschöpfung ist für die meisten Abbauländer gut, da nicht nur der Abbau sondern auch die Weiterverarbeitung in einem Land erfolgt. Dadurch bleiben Gewinne im Land, und es werden Einnahmen in Form von Steuern generiert.
Für eine verantwortungsvolle Metall-Produktion gewinnt die Sorgfaltspflicht in den Lieferketten in der EU zunehmend an Bedeutung. Dazu zählen auch die Dokumentation oder Zertifizierung von Sozialstandards und Arbeitsschutz.
Entsorgung und Recycling
Edelstahl ist ein langlebiges Produkt und kann wiederverwendet werden. Die End-of-life Recyclingrate beträgt für Nickel 68 %. Ca. 15% des recycelten Nickels werden in Karbonstählen ohne funktionellen Nutzen eingesetzt (sogenanntes Downcycling), weitere 17 % landen mit nickelhaltigen Produkten auf Mülldeponien.
Insgesamt ist die Recyclingrate für Nickel höher als für die meisten anderen Metalle, rund 57% des seit dem 18. Jahrhunderts geförderten Nickels sind noch im Einsatz. Die Europäische Batterieverordnung legt für Nickel eine Recyclingrate von 90% im Jahr 2027 fest.
Wie lässt sich das Material nachhaltiger gestalten?
Eine weitere Erhöhung der Recyclingrate aus Batterien und Akkumulatoren wie in der Europäischen Batterieverordnung vorgesehen, würde zu einer Verringerung der Förderung von Nickel beitragen, und die damit verbundenen Umweltauswirkungen reduzieren.
Weiterführende Literatur
- Nickel Magazin, 4 | NICKEL, JHRG. 33, NR. 2, 2018, Nickel und Nachhaltigkeit: Auf dem Weg zur Kreislaufwirtschaft, https://nickelinstitute.org/media/3522/nickelvol33no2summer2018_de_fb.pdf
- Nickel – Informationen zu Nachhaltigkeit, Bundesanstalt für Geowissenschaften und Rohstoffe, 2021, https://www.bgr.bund.de/DE/Gemeinsames/Produkte/Downloads/Informationen_Nachhaltigkeit/nickel.html
Nickel ist ein sehr vielseitig einsetzbares Element, das in verschiedenen chemischen Formen (Metall, Legierung, Oxid und weitere Verbindungen) in unterschiedlichen Produkten eingesetzt wird. Durch die breite Verwendung kann es hauptsächlich zur Exposition am Arbeitsplatz, aber auch zu Hautkontakten bei Verbrauchern kommen.
Kontakt im Alltag
Seit hundert Jahren ist bekannt, dass Nickel bei intensivem Kontakt zu Veränderungen in der Haut führt [Bulmer and Mackenzie, 1926]. Daher wurde es in den vergangenen Jahrzehnten in unterschiedlichen Formen und Verbindungen am Arbeitsplatz oder auch bei Nutzern auf seine Wirkungen hin untersucht. Seit dieser Zeit ist bekannt, dass Nickel in metallischen Legierungen bei Körperkontakt Kontaktallergien (Kontaktdermatitis) auslösen kann. Nickel ist das häufigste von über 2.000 Kontaktallergenen und allein in Deutschland gibt es ca. 2 Millionen Betroffene .
Aus diesem Grund hat die EU überall dort, wo Nickel als Ion freigesetzt werden könnte (z.B. Besteck, Piercingschmuck, Brillengestelle, Knöpfe und Reißverschlüsse, Spielzeug), sehr tiefe Grenzwerte für den Einsatz von Nickel festgelegt , die für sehr sensible Menschen jedoch auch nicht niedrig genug scheinen . Dennoch gibt es immer wieder neue Produkte und Entwicklungen, die für eine erneute Expositionsquelle sorgen, wie z.B. Mobiltelefone und deren metallischen Ränder bzw. Schaltknöpfe oder Euro-Münzen . Allerdings sind auch Tabakprodukte und e-Zigaretten eine Quelle für eine Nickelbelastung.
Innovative Produkte, wie Batterien oder Brennstoffzellen, sind dagegen kaum eine Quelle für den Verbraucher, um mit Nickel in Kontakt zu kommen.
Situation am Arbeitsplatz

Blechrollen im Lager für Aluminiummaterial
@ amorn-stock.adobe.com
Zu Nickel und seinen Verbindungen gibt es aus den vergangenen Jahrzehnten sehr viele Studien. Ohne diese Vielzahl an Studienergebnissen zu wiederholen, sollen hier nur einige repräsentative Arbeiten zitiert werden. Diese Studien verdeutlichen, dass ungeschütztes Arbeiten an staubbelasteten Arbeitsplätzen, an denen Nickel verarbeitet wird, zu verschiedenen biologischen Effekten führen kann. Die wohl wichtigste Wirkung ist die direkte Auslösung von entzündlichen Prozessen in der Lunge. Sie beruhen auf oxidativem Stress, schließen aber auch eine Interaktion mit der DNA als auch mit den DNA-Reparaturenzymen ein . Dadurch können schwere Organschäden bis hin zur Tumorbildung hervorgerufen werden. Sobald sich Partikel, die aus Nickel oder seinen Verbindungen bestehen, in der Lunge auflösen, können Nickel-Ionen leicht in den Körper und somit auch in den Blutkreislauf gelangen und innere Organe erreichen.
Zwei Studien aus Indien erfassten den Zusammenhang von Nickel- oder Chrombelastung mit der Samenqualität der männlichen Arbeiter oder möglicher DNA-Schädigung in weißen Blutzellen . Die Wirkung auf die DNA wird dadurch verstärkt, dass die DNA-Reparaturmechanismen der Zellen ebenfalls durch Nickel-Ionen gehemmt werden und damit Schäden länger bestehen bleiben . Eine retrospektive Studie von verrenteten Arbeitern einer Nickel- Raffinerie (Nickel Veredelung) konnte nachweisen, dass mit Nickel belastete Arbeiter eine erhöhte Rate an chromosomalen Defekten aufwiesen . Studien zur Gentoxizität und kanzerogenen Wirkungen von Nickel auch in Partikeln unterschiedlichster Größe wurden in verschiedenen Übersichten gut zusammengefasst . Auf der Basis vieler Studien hat die Weltgesundheitsorganisation (WHO) Nickel und seine Verbindungen schon seit 1973 als kanzerogen eingestuft. Aktuell (2023) ist Nickel in seinen Verbindungen (z.B. NiO u.a.) sowohl in der EU in der Gruppe 1 (CLP - Carc 1A: krebserregend) als auch von der WHO in der Gruppe 1 klassifiziert (IARC Group 1 „krebserregend im Menschen“) [WHO, 2012]. Diese Wirkung ist hauptsächlich mit dem Aufnahmeweg über die Lunge verbunden, orale Aufnahme dagegen ist nicht mit einer tumorauslösenden Wirkung verknüpft. Als metallisches Partikel ist Nickel in der EU in die Gruppe Carc 2 (Verdacht auf Kanzerogenität beim Menschen) eingruppiert und bei der WHO in der IARC Group 2B (möglicherweise krebserregend) eingeordnet.
Situation beim Verbraucher
Nickel wirkt im Menschen hauptsächlich in seiner ionischen Form. Daher muss es aus seiner metallischen Form aus Legierungen oder aus Schichten und anderen Anwendungen herausgelöst werden. Dies geschieht meist auf der Haut über den Schweiß, z.B. aus Schmuck, Piercings, Münzen und Mobiltelefonoberflächen, anderen nickelhaltigen Produkten oder aus eingeatmeten Staubpartikeln in der Lunge . Die bekannte giftige Wirkung des Nickels als Kontaktallergen bzw. die kanzerogene Reaktion bei dauerhafter Exposition über die Lunge führte folgerichtig zu strengen Grenzwerten und Sicherheitsmaßnahmen am Arbeitsplatz, aber auch für Verbraucher und Verbraucherinnen.
Nickel wird vielseitig eingesetzt. Allerdings muss bei der Verarbeitung und beim Gebrauch besondere Aufmerksamkeit auf seine gesundheitlichen Wirkungen gelegt werden. Es ist eines der stärksten Kontaktallergene. Nach Exposition über die Lunge kann es krebsauslösend wirken, so dass die gesetzlichen Grenzwerte für eine Exposition sehr niedrig sind. In vielen innovativen Produkten enthalten (Batterien, Brennstoffzelle), kommen Verbraucher und Verbraucherinnen allerdings nicht mit dem darin enthaltenen Nickel in Berührung.
Die Freisetzung von Nickel-Nanopartikeln in die Umwelt erfolgt während verschiedener Phasen des Lebenszykluses, einschließlich Herstellung, Verwendung, Entsorgung und versehentlicher Verschüttungen. Dabei sind insbesondere aquatische Organismen gefährdet, da Nickel durch Auslaugung, d.h. das herauslösen von Nickel durch das Auswaschen, in aquatische Ökosysteme gelangt. Darüber hinaus können Nickel-Nanopartikel mit anderen in der Umwelt vorhandenen Schadstoffen interagieren.
Generelle Freisetzung von Nickel

Nickelabbau, Philippinen ©MARYGRACE - stock.adobe.com
Nickel gelangt durch verschiedene menschengemachte Quellen in die Umwelt, wie zum Beispiel Erzabbau, Verbrennungsprozesse und die Entsorgung von nickelhaltigen Produkten. Dies geschieht in Form verschiedener Nickelverbindungen, einschließlich Sulfide, Oxide, Silikate, löslicher Verbindungen und in geringerem Maße auch des Elements Nickel selbst. Nickel und Nickelverbindungen können in der Umgebungsluft, im Trinkwasser, in Lebensmitteln und Tabakprodukten nachgewiesen werden .
In Bezug auf den Boden ist der Bergbau eine bedeutende Quelle anthropogener, d.h. menschengemachte Nickelkontamination aufgrund der Freisetzung von Nickel und anderen Metallen während des Abbauprozesses. Nickel kann durch Regenwasser oder Oberflächenwasser ausgewaschen werden und in das aquatische Ökosystem gelangen .
Während der Verwendung kann Nickel aufgrund von Verschleißeffekten aus verschiedenen Anwendungen in die Luft freigesetzt werden (weitere Informationen unter Materialinformationen). Da die Entsorgung manchmal nicht ordnungsgemäß durchgeführt wird, kann Nickel auch durch Auslaugen aus Deponien in den Boden gelangen. Letztendlich gelangt Nickel durch Regen oder Grundwasser in verschiedenste Gewässer .
Ineffiziente Fahrzeugmotoren stoßen aufgrund ihrer Schmierstoffe ebenfalls Nickel während des Fahrens aus. Darüber hinaus spielt Nickel eine Rolle in verschiedenen Anwendungen, einschließlich der Ölraffinerie, , Umweltschutzgeräte und Materialien für die Sanitärtechnik.
Es besteht die Möglichkeit, dass Nickel ins Trinkwasser gelangt, wenn Rohre und andere Materialien rosten, obwohl diese Lecks in der Regel geringfügig sind. Andere Quellen für Nickelbelastung sind Nickellegierungen und Gegenstände, die mit Nickel beschichtet sind, wie Stahl, Münzen und Schmuck. Rückstände von Nickel können auch in Seife, Ölen und Fetten gefunden werden .
Freigesetzte Mengen an Nickel
Nickel wird hauptsächlich durch menschliche Aktivitäten in die Atmosphäre freigesetzt, wobei etwa 1,4 bis 1,8 Mal mehr Emissionen durch den Menschen erzeugt werden als von der Natur. In den 1980er Jahren machte die Verbrennung fossiler Brennstoffe 62% der anthropogenen Nickel-Emissionen in der Atmosphäre aus, insgesamt 570.000 Tonnen weltweit im Jahr 1999. Davon trugen Elektrizitätsversorgungsunternehmen 326 Tonnen bei, Müllverbrennungsanlagen 12%, Nickel-Metallverarbeitung 17%, Stahlproduktion 3% und andere nickelhaltige Legierungen 2%.
In Wasser, abgesehen von industriellen Prozessen wie Bergbau und Metallverhüttung, kann Nickel in Industrieabwässern, Abwässern aus Haushalten und Deponiesickerwasser gefunden werden. Meerwasser enthält etwa 0,5 bis 2 mg/L Nickel, während Flüsse etwa 0,3 mg/L Nickelverbindungen enthalten. Die empfohlene akzeptable Grenze für Nickel im Trinkwasser gemäß Europäischem Parlament beträgt 20 µg/L, d.h. ist um das 15-fache geringer als in den Flüssen vorhandenen Mengen (dazu RICHTLINIE (EU) 2020/2184).
Grundwasser mit einem pH-Wert unter 6,2 kann aufgelöste Nickelkonzentrationen von bis zu 0,98 g/L aufweisen. Proben von Regenwasserabflüssen in städtischen Gebieten haben Nickelwerte von <1 bis 87 g/L gezeigt.
Nickelwerte im Boden stammen hauptsächlich aus anthropogenen Quellen wie Abfällen aus der Metallherstellung, gewerblichen Abfällen, Niederschlägen, Schlamm, Kohlenflugasche, Kohlenbodenasche, Bergbau und Verhüttung. Im Jahr 2002 wurde beispielsweise geschätzt, dass aus US-amerikanischen Produktions- und Verarbeitungsbetrieben etwa 5530 Tonnen Nickel und 14.800 Tonnen Nickelverbindungen in die Umwelt freigesetzt wurden, was etwa 82% bzw. 87% der geschätzten Gesamtnickelfreisetzung in die Umwelt entspricht. Obwohl das Problem der Nickelverschmutzung in städtischen Gebieten am ausgeprägtesten ist, beeinflusst es auch landwirtschaftliche Böden aufgrund reduzierter Bodenkalkung und der Auswirkungen von saurem Regen infolge der Industrialisierung .
Nickel und Nickelverbindungen sind in der Umwelt allgegenwärtig, und menschliche Aktivitäten führen zu ihrer Freisetzung in alle Umweltkompartimente.
Primäre Quellen einer Aufnahme von Nickel sind zum einen Nahrungsmittel und auf niedrigem Level Luft und Trinkwasser. Generell kann Nickel aber auch aus Produkten gelöst werden, z.B. aus nickelhaltigen Stählen in Kochtöpfen oder aus Knöpfen, Schmuck und Spielsachen. Daher sind die Haut, der Magen-Darm-Trakt und, für den Arbeitsplatz durch nickelhaltige Stäube, auch die Lunge die potenziellen Aufnahmewege.
Aufnahme über die Lunge
Nickelhaltige Stäube spielen vor allem am Arbeitsplatz eine wichtige Rolle, wenn die potenzielle Wirkung von Nickel und seinen Verbindungen in der Lunge betrachtet wird. Durch die Eingruppierung von Nickel in seinen Verbindungen als eindeutig kanzerogen bei Aufnahme über die Lunge (IARC Group 1 „krebserregend im Menschen“) und metallische Nickelpartikel in der Gruppe IARC Group 2B („möglicherweise krebserregend“) sind die Grenzwerte am Arbeitsplatz auch entsprechend niedrig. Persönliche Schutzmaßnahmen sind gesetzlich vorgeschrieben.
Die Grenzwerte sind für Deutschland in den Technischen Regeln für Gefahrstoffe Nr. 900 und Nr. 910 festgelegt und betragen für Nickel in seinen Verbindungen 30 µg/m3 in der E-Staub Fraktion und für metallisches Nickel 6 µg/m3 in der A-Staub Fraktion (Staubfraktionen siehe auch Granuläre biobeständige Stäube). Allerdings können auch akute Belastungen mit Nickel unmittelbar zum Tod führen, wie ein gut dokumentierter Fall in Südafrika zeigte . Hier war ein männlicher Mitarbeiter damit beschäftigt, Turbinenblätter mit Nickel zu bedampfen. Der 38jährige war weder gut eingewiesen noch verwendete er ausreichende Schutzmaßnahmen und hatte seine Atemmaske des Öfteren während des 90minütigen Vorgangs abgesetzt. Er konsultierte bereits am folgenden Tag einen Arzt wegen Atemproblemen, wurde 4 Tage später in eine Klinik eingewiesen und verstarb dennoch am „Akuten Atemnotsyndrom“ 13 Tage nach Exposition. In seinem Urin konnten 780 µg/l Nickel nachgewiesen werden und auch in der Lunge fanden sich in Makrophagen viele Nickeloxid-Nanopartikel, die bei der Bedampfung eingesetzt wurden.
Tabakprodukte können relativ hohe Mengen an Nickel von 1,7 bis 4,2 µg/g enthalten. Somit wird die Lunge von Rauchern zusätzlich durch das Kondensat des Tabakrauchens mit Nickel belastet . Allerdings kommen beide Studien zu leicht unterschiedlichen Ergebnissen, was die Aufnahme in den Körper des Menschen angeht. Während die norwegische Studie keinen Unterschied in der Menge an Nickel im Blut und im Urin zwischen den Rauchern und den Nichtrauchern der beruflich belasteten Gruppe nachweisen kann, aber dennoch ein erhöhtes Krebsrisiko bei den rauchenden Arbeitnehmern findet , beschreibt die zweite Studie einen deutlichen Unterschied des Nickelgehaltes im Urin. Während im Blut ebenfalls kein Unterschied zwischen Rauchern und Nichtrauchern nachgewiesen werden konnte, lag der Nickelwert im Urin bei den Rauchern bis zu doppelt so hoch im Vergleich zu Nichtrauchern . Generell ergaben diese Studien aber in jedem Fall ein erhöhtes Risiko für Lungenerkrankungen bei Doppelbelastung durch Nickel als auch durch den Tabakrauch.
Aufnahme über die Haut
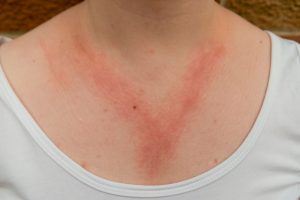
Hautausschlag als Reaktion auf Nickelschmuck. ©HASPhotos-stock.adobe.com
Metallisches Nickel spielt auf der Haut eine bedeutende Rolle und ist eines der häufigsten Kontaktallergene, die wir kennen. Die verbreiteten Quellen für eine Nickelexposition sind Schmuck (z.B. Modeschmuck, vor allem Ohrstecker und Piercings), aber auch Reißverschlüsse, Knöpfe, Tätowiermittel (in Deutschland sind nickelhaltige Tätowiermittel nicht erlaubt), Spielzeuge, Mobiltelefone und Münzen. Durch Schweiß auf der Haut wird das Nickel aus den Legierungen herausgelöst und kann in seiner ionischen Form tief in Hautschichten vordringen und so lebende Immunzellen erreichen. Dort entfaltet es seine allergisierende Wirkung als sogenanntes „Hapten“. Ohrstecker oder Piercings sind hier besonders kritisch zu betrachten, da ein Kontakt zum Blut möglich ist. Blut kann Nickel-Ionen schneller lösen als Schweiß. Aus diesem Grund sind die Grenzwerte für eine Nickelfreisetzung aus Piercings und Ohrsteckern deutlich niedriger (0,2 µg Ni/cm2/Woche) als diejenigen für andere Verbraucherprodukte oder Mobiltelefone (0,5 µg Ni/cm2/Woche) . Diese Grenzwerte können aber erheblich überschritten werden, wie Untersuchungen an Euromünzen (>100 µg Ni/cm2/Woche), Mobiltelefonen (20 µg Ni/cm2/Woche) und Metallbaukästen gezeigt haben .
Aufnahme über den Verdauungstrakt
Die Aufnahme von Nickel über den Magen-Darm-Trakt geht meist über Lebensmittel oder Trinkwasser. Die Belastungen der Lebensmittel bzw. des Trinkwassers mit Nickel sind aber in Europa so niedrig, dass über diesen Weg kaum eine Gefährdung des Menschen anzunehmen ist. Akut toxisch wäre eine Menge von deutlich mehr als 100 mg/kg Körpergewicht pro Tag. Bei einer chronischen Aufnahme spielt jedoch die sensibilisierende Wirkung von Nickel eine Rolle. Daher legte die Europäische Behörde für Lebensmittelsicherheit (EFSA) einen akzeptierbaren täglichen Aufnahmewert (TDI) von max. 13 µg/kg Körpergewicht und Tag für Erwachsene und 11 µg/kg Körpergewicht bei Jugendlichen fest . Das in den Körper aufgenommene Nickel wird über den Harn wieder ausgeschieden. Für den unbelasteten Menschen wurde ein Referenzwert von 3 µg Nickel/l Harn in mehreren Studien beschrieben, so dass bei einer höheren Ausscheidung ein Indiz für eine besondere Belastung vermutet werden kann .
Nickel gelangt in den menschlichen Körper meist über die Lebensmittel, deren Belastung in Industrieländern jedoch sehr niedrig ist und keine Gefährdung darstellt. Rauchen kann allerdings die Aufnahme deutlich erhöhen und Arbeitsplätze sind ebenfalls belastet, so dass wegen der krebserregenden Wirkung von Nickel die Grenzwerte für Nickel und seine Verbindungen sehr niedrig festgesetzt wurden.
Weiterführende Informationen
- EU (2004): Richtlinie 2004/96/EG der Kommission vom 27. September 2004 zur Änderung der Richtlinie 76/769/ EWG des Rates vom 27. Juli 1976 hinsichtlich der Beschränkungen des Inverkehrbringens und der Verwendung von Nickel für nach dem Durchstechen von Körperteilen eingeführte Erststecker zwecks Anpassung ihres Anhangs I an den technischen Fortschritt (Text von Bedeutung für den EWR). https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32004L0096&qid=1694433190863
- Technische Regel für Gefahrstoffe TRGS 900 „Arbeitsplatzgrenzwerte“, GMBl 2023 (35), 755-756 (Download unter: https://www.baua.de/DE/Angebote/Regelwerk/TRGS/pdf/TRGS-900.pdf?__blob=publicationFile&v=5 )
- Technische Regel für Gefahrstoffe TRGS 910 „Risikobezogenes Maßnahmenkonzept für Tätigkeiten mit krebserzeugenden Gefahrstoffen“, GMBl 2023 (32), 679 (Download unter: https://www.baua.de/DE/Angebote/Regelwerk/TRGS/pdf/TRGS-910.pdf?__blob=publicationFile&v=6)
- UBA (2013): Nickel. (pdf)
Nickel in seiner ionischen Form ist ein bekanntes Gift und wird als gewässergefährdend eingestuft. Die Toxizität von Nickel-Nanopartikeln und Nickelverbindungen kann sich aufgrund von unterschiedlichen Partikelgrößen, Oberflächenreaktivität und dem Oberflächenpotenzial zur Aufnahme in die Zellen in Bezug auf Nickelionen oder dem Element Nickel unterscheiden.
Aufnahme von Nickel in Umweltorganismen
Nickel ist ein essentieller Mikronährstoff für Tiere und Pflanzen und spielt eine wichtige Rolle bei zellulären Reaktionen und der allgemeinen Entwicklung. Wenn die Nickelkonzentration jedoch die zulässigen Grenzwerte überschreitet, stört sie verschiedene Zellbestandteile, was zu Schäden führen kann. Die meisten Nickelverbindungen, mit Ausnahme von Nickelcarbonyl, sind bei der Aufnahme relativ ungiftig, da sie nur schlecht vom Magen-Darm-Trakt aufgenommen werden. Die Bioverfügbarkeit von Nickel wird durch den Verzehr von Nahrungsmitteln beeinflusst und es wird schnell über den Urin ausgeschieden, wobei die Ausscheidung nicht dosisabhängig ist. Studien an Hühnern zeigen, dass eine Nickelbelastung den Gehalt an Magnesium, Mangan und Zink in verschiedenen Geweben verringert, wobei Nickel und Zink bei Tieren entgegengesetzte Wirkungen aufweisen.
Was die Auswirkungen von Nickel- und Nickeloxid-Nanopartikeln auf Umweltorganismen betrifft, so wurden die Aufnahme und der Verzehr durch verschiedene Umweltorganismen (Tiere wie Zebrafische, Amphipoden oder Wasserflöhe sowie Pflanzen wie Gerste, Kohl oder Algen) beobachtet. Organismen können Nickel-Nanopartikel in ihrem Gewebe anreichern, was zu Bedenken hinsichtlich einer potenziellen Anreicherung und somit höheren Konzentration von Nickel in Tieren und Pflanzen führt.
Toxizität von Nickel in Umweltorganismen
Nickel- und Nickeloxid-Nanopartikel wurden hinsichtlich ihrer Auswirkungen auf verschiedene Tier- und Pflanzenarten untersucht, darunter Würmer, Insekten, Amphipoden, Seeigel, Fische, Grünalgen, Kohl und Hefe. Es wurden mehrere Lebensstadien betrachtet. Die am häufigsten beobachteten Mechanismen sind die genotoxische Wirkung sowie die Auslösung von oxidativem Stress, was zu systemischen Wirkungen wie Organschäden und vermindertem Wachstum bei Tieren wie Zebrafischen, Amphipoden oder Fischen und zur Hemmung der Photosynthese bei Pflanzen wie Wasserlinsen oder Gerste führt.
Insgesamt wird angenommen, dass Nickelionen für die toxischen Wirkungen verantwortlich sind. Ob es auch spezifische Wirkungen von Nickel-Nanomaterialien gibt, wird etwas kontrovers diskutiert. Einige Studien berichten von einer spezifischen, meist höheren Toxizität von Nickel-Nanomaterialien. Eine aktuelle Übersichtsarbeit zur Toxizität von Nickel-Nanopartikeln in Wasserorganismen zeigt jedoch eine unzureichende Datenqualität im Vergleich zu Studien über Nickel-Ionen. Einige allgemeine Erkenntnisse über die Toxizität von Nanomaterialien treffen auf Nickel-Nanopartikel nicht zu. Nickel- und Nickeloxid-Nanopartikel weisen im Allgemeinen trotz unterschiedlicher Zusammensetzung eine ähnliche Toxizität auf, und die Toxizität nimmt mit kleinerer Partikelgröße nicht zu. In Bezug auf die Massenkonzentration sind Nickel-Nanopartikel nicht giftiger als Nickel-Ionen. Die Toxizitätsmechanismen von Nickel-Nanopartikeln stimmen jedoch mit dem oxidativen Stress überein, der bei anderen metallischen Nanomaterialien beobachtet wird.
Bei einigen Organismengruppen wurden jedoch nanopartikelspezifische Wirkungen beobachtet. Beispielsweise zeigten Zebrafischembryonen eine höhere Toxizität gegenüber Nickel-Nanopartikeln im Vergleich zu anderen Partikelgrößen. Amphipoden, die Nickeloxid-Nanopartikeln ausgesetzt waren, reicherten höhere Nickelmengen in ihrem Gewebe an. Copepoden reagierten empfindlicher auf gelöste Nickel-Ionen als auf Nickel-Nanopartikel, und die Anwesenheit von Tensiden beeinflusste die Toxizität von Nickel-Nanopartikeln für Wasserflöhe. Es wurde nachgewiesen, dass Pflanzenwurzeln Nanopartikel aufnehmen, die in den Boden gelangen.
Die Studien zeigen auch, dass Faktoren wie die Dauer der Einwirkung, der langfristige Verbleib von Nanopartikeln in Organismen und die spezifische Form der Nanopartikel eine wichtige Rolle bei der Bestimmung der Gesamttoxizität spielen. Die Toxizität von Nickel- und Nickeloxid-Nanopartikeln kann zu zellulärem oxidativem Stress, Veränderungen der Aktivitäten antioxidativer Enzyme und Schäden an verschiedenen Organen und Geweben führen. Außerdem wurden Auswirkungen wie verändertes Verhalten, vermindertes Wachstum und Auswirkungen auf die Fortpflanzung beobachtet .
Beurteilung der Effekte von Nickel auf Umweltorganismen
Die Studien über die Toxizität von Nickel und seinen Verbindungen sowie von Nickel- und Nickeloxid-Nanopartikeln haben unterschiedliche Grade der Toxizität und potenzielle Gefahren für verschiedene Organismen ergeben. In Bezug auf Nickel-Nanopartikel unterstreichen die Studien die Bedeutung der Berücksichtigung spezifischer physikochemischer Eigenschaften von Nanopartikeln bei der Bewertung der Toxizität. Nickel ist in seinen verschiedenen Erscheinungsformen allgegenwärtig in der Umwelt verteilt. An den meisten Orten liegen die Konzentrationen in Bereichen, die von Tieren und Pflanzen gut vertragen werden. In bestimmten Gebieten wie Bergbaustandorten oder Mülldeponien treten jedoch hohe Nickelkonzentrationen auf, die Organismen schädigen. Die Empfindlichkeit der verschiedenen Organismen gegenüber Nickel ist jedoch unterschiedlich.
Um die ermittelten Toxizitätswerte mit den tatsächlichen oder modellierten Umweltkonzentrationen in Beziehung zu setzen, hat die EU in der Wasserrahmenrichtlinie jährliche Durchschnittskonzentrationen für bioverfügbares Nickel festgelegt, die auf 4 µg/L begrenzt sind (Umweltqualitätsstandards für prioritäre Stoffe aufgelistet von der ECHA).
Zusammenfassend lässt sich sagen, dass die umfangreichen Forschungsarbeiten über die Toxizität von Nickel in verschiedenen Organismen und Ökosystemen die komplexe und vielfältige Natur ihrer Auswirkungen unterstreichen. Nickel kann oxidativen Stress auslösen, Zellen und Gewebe schädigen und lebenswichtige physiologische Prozesse in einer Reihe von Arten stören, von Wasserorganismen wie Zebrafischen, Amphipoden und Copepoden bis hin zu an Land lebenden Organismen wie Pflanzen, Würmern und Hefe. Die spezifischen Mechanismen der Toxizität sowie die Empfindlichkeit variieren von Organismus zu Organismus. Was das Verständnis von Nickel- und Nickeloxid-Nanopartikeln betrifft, so sind die Ergebnisse zu den spezifischen Wirkungen nicht schlüssig und erfordern detaillierte Kenntnisse über Eigenschaften, Umweltverhalten und Zusammensetzung.
Nickel hat bereits in niedriger Dosierung Effekte sowohl in der Haut als auch nach Aufnahme durch die Lunge oder im Körper. Weil Nickel in seinen Verbindungen nachgewiesenermaßen krebserregend ist, sind die Grenzwerte sehr niedrig gesetzt, sowohl für den Arbeitsplatz als auch für Verbraucher und Verbraucherinnen.
Verteilung und Wirkung im Körper
Metallisches Nickel oder auch metallische Nickelpartikel sind für den Organismus biologisch weniger verfügbar als ionische Nickelverbindungen (z.B. Nickeloxid NiO oder Nickelchlorid NiCl2). Nickel wirkt aber im Körper erst, wenn es als Ion (Ni2+) aus dem Material oder Molekül herausgelöst wird. Dies geschieht aus metallischem Material sehr viel langsamer bzw. schlechter als aus seinen Verbindungen, in denen das Nickel bereits ionisch vorliegt, wie z.B. im Nickeloxid (NiO). Nickeloxid wird auch sehr häufig als Nanopartikel verwendet und ist somit ein wichtiges Ausgangsmaterial für toxikologische Studien. Wird Nickel als Salz eingesetzt (Nickelchlorid) ist es gut löslich und steht als Ion zur Verfügung. Eine vergleichende Studie an Hamstern konnte zeigen, dass Nickelchlorid auf die Haut aufgetragen in den Körper gelangt und dort verteilt und über den Urin ausgeschieden wird . Dies geschieht aber erheblich langsamer im Vergleich zu intramuskulär injiziertem Nickelchlorid, das innerhalb von 24 h zum großen Teil ausgeschieden wurde. Obwohl die grundsätzliche Aussage zu Aufnahme und Verteilung von Nickel im Organismus stimmig ist, hat diese frühe Studie eine Reihe von methodischen Mängeln.
Eine andere beispielhafte Studie zu NiO-Nanopartikeln wurde 20 Jahre später durchgeführt und ergab prinzipiell ähnliche Ergebnisse . Die den Ratten oral verabreichten NiO-Partikel wurden in den Organismus aufgenommen und verteilten sich in den Organen. Wie schon für andere Nanopartikel gezeigt werden konnte, reichern sich die Nickeloxidpartikel vor allem in der Leber an. Jedoch zeigten auch andere Organe wie die Niere und die Milz deutlich erhöhte Werte für NiO nach 24 h. Eine wichtige Erkenntnis ist, dass bei hohen Konzentrationen bereits nach kurzer Zeit DNA-Schäden in der Leber und den Nieren nachgewiesen werden konnten. Ähnliche Effekte durch verschiedene Nickelverbindungen (Ni3S2, NiO, NiCl2 und NiSO4) konnten schon recht früh auch bei Arbeitern in einer Nickelfabrik festgestellt werden . Die Luft am Arbeitsplatz war damals mit mehr als 1 mg/m3 belastet und es konnten vermehrt DNA-Strangbrüche nachgewiesen werden. Das deckt sich mit späteren Studien, in denen ebenfalls an hoch belasteten Arbeitsplätzen eine erhöhte Frequenz für Mikrokerne (ein Effekt, der auf DNA-Schädigung hindeutet) und DNA-Strangbrüche bei den Mitarbeitern auftrat . In einem sehr guten Übersichtsartikel wurden diese und viele weitere Studien zur Wirkung von Nickeloxiden auf Tier und Zellen zusammengefasst . Nach Inhalation von NiO- und Ni(OH)2-Partikeln wurden in Ratten und Mäusen immer entzündliche Prozesse und oxidativer Stress nachgewiesen. Weiterhin wurden nachfolgend auch systemische Effekte in anderen Organen wie Leber, Niere, Milz u.a. beobachtet. Die gleichen Effekte gab es nach Injektion in die Bauchhöhle oder auch nach oraler Aufnahme, was bedeutet, dass Nickel, über alle Wege aufgenommen, ähnliche Wirkungen zeigt. Besonders schwerwiegend sind allerdings immer die begleitenden genotoxischen Effekte, durch die auch die krebsauslösende Wirkung erklärt werden kann.
Aufnahme und Wirkung in Zellen
Die Aufnahme von Nickel in seinen Verbindungen wurde umfassend schon vor einigen Jahren beschrieben und zusammengefasst . In diesem Artikel werden viele Studien aufgeführt, die sowohl die Aufnahme unterschiedlicher Nickelverbindungen und Partikel gezeigt haben, als auch die intrazelluläre Umwandlung der Partikel in gelöste Ni-Ionen in den Lysosomen beschrieben haben. Die Tatsache, dass sowohl metallisches als auch oxidisches Nickel in Lysosomen aufgelöst werden können, wurde durch eine Arbeitsgruppe in Schweden nachgewiesen . Metallische Nano- oder Mikropartikel als auch NiO-Nanopartikel lösten sich in künstlicher lysosomaler Flüssigkeit auf, die metallischen sogar zu fast 100% nach 24 h. Die gelösten Nickel-Ionen können dann in der Zelle mit unterschiedlichen Molekülen und im Zellkern auch mit der DNA interagieren. Dabei ist eine wichtige Reaktion die Hemmung der Reparatur von DNA-Schäden, die in verschiedenen Zellen nachgewiesen wurde . Die gute Aufnahme in den Organismus und in die Zellen unterschiedlicher Organe, die schnelle Auflösung auch von schwerlöslichen Partikeln in den Lysosomen der Zellen und die Interaktion mit Proteinen (Kontaktallergie) und DNA und deren Reparaturmechanismen (Krebsinduktion) macht Nickel zu einem potenziellen Risiko am Arbeitsplatz und auch für Verbraucher und Verbraucherinnen, die ausreichend hohen Konzentrationen von Nickel ausgesetzt sind.
Nickel ist ein toxisches Metall, das in seinen Verbindungen krebsauslösend ist und auf der Haut zu Kontaktallergien führt. Aus diesem Grund sind für Nickel und seine Verbindungen sehr niedrige Grenzwerte festgelegt worden, um Arbeitnehmer und Arbeitnehmerinnen als auch Verbraucher und Verbraucherinnen zu schützen.
Nickel ist in der Umwelt weit verbreitet. Natürliche Nickelquellen werden durch geologische Prozesse (z. B. Erosion, Ablagerung oder Verschiebung der Erdplatten) in Böden und Sedimente freigesetzt, während menschengemachte Aktivitäten wie Ausstöße durch die Industrien und Verbrennungsprozesse Nickel in Luft und Wasser eintragen. In der Atmosphäre kommt Nickel hauptsächlich in Form von Partikeln vor. In Gewässern werden das Verhalten und die Verfügbarkeit von Nickel von Faktoren wie dem pH-Wert oder dem Vorhandensein von organischen Bindungsmolekülen beeinflusst, was sich auf seine Verteilung und seine potenziellen Umweltauswirkungen auswirkt.
Transport von Nickel
Verschiedene geologische Prozesse sorgen für eine kontinuierliche Umverteilung von Nickel im Boden, im Wasser und in der Luft. In der Atmosphäre ist Nickel in relativ geringen Konzentrationen vorhanden. In die Atmosphäre freigesetztes Nickel tritt hauptsächlich in Form von Partikeln auf, deren Durchmesser je nach Quelle variiert. Durch die menschlichen Aktivitäten hervorgerrufene Nickelpartikel haben in der Regel eine Größe von 0,1 mm bis 2 mm, während die aus natürlichen Quellen stammenden Partikel einen Durchmesser von 2 mm bis 10 mm aufweisen. Feine Nickelpartikel mit einer Größe von weniger als 10 mm bleiben länger in der Atmosphäre, in der Regel 5-8 Tage, und können im Vergleich zu größeren Nickelpartikeln über größere Entfernungen transportiert werden.
Diese Nickelpartikel verbreiten sich durch den Wind und setzen sich durch Schwerkraft (bei Partikeln mit einer Größe von mehr als 5 mm) oder durch trockene und nasse Ablagerung (bei Partikeln mit einer Größe von weniger als 5 mm) in der Atmosphäre ab.
Bemerkenswert ist, dass Nickelpartikel keine Infrarotstrahlung absorbieren, was bedeutet, dass sie wahrscheinlich nicht zur globalen Erwärmung oder zum Abbau der Ozonschicht in der Stratosphäre beitragen .
Transformation von Nickel
Im Allgemeinen lagern sich zahlreiche Metalloxid-Nanopartikel schnell bis in den Mikrometerbereich zusammen, wenn sie in das Meerwasser eingebracht werden, was dazu führt, dass sie sich in der Wassersäule absetzen. Folglich haben Nanomaterialien das Potenzial, sich in Sedimenten anzusammeln. Sobald sie sich in den Sedimenten abgesetzt haben, können sie mit partikelförmigen organischen Stoffen interagieren, sich ablagern und anschließend physikalischen und biogenen Prozessen wie bakterieller Zersetzung oder Bioturbation unterliegen . Für Nickel-Nanopartikel wurde das Sediment als bedeutende Senke identifiziert, vor allem aufgrund ihrer Aggregation, Bindung und Ablagerung durch Muscheln oder Austern. Das Verständnis des Verbleibs und des Transports von Nickel-Nanopartikeln ist von entscheidender Bedeutung, wenn man ihre potenzielle Anreicherung in Sedimenten und die mögliche Übertragung auf Sedimentorganismen berücksichtigt.
Was die Atmosphäre betrifft, so ist unser Wissen über die chemischen Formen und die chemischen und physikalischen Umwandlungen, die Nickel durchläuft, nach wie vor begrenzt. Es wird allgemein angenommen, dass Nickel aus menschlichen Quellen, insbesondere aus Verbrennungsprozessen, hauptsächlich in Form von Nickeloxid vorliegt. Umgekehrt ist es wahrscheinlich, dass windverwehte Staubpartikel Mineralsulfidarten von Nickel enthalten. Darüber hinaus ist es wahrscheinlich, dass Nickelsulfat in der Atmosphäre durch die Oxidation von Nickel in Gegenwart von Schwefeldioxid gebildet wird.
Nickel kommt in aquatischen Systemen meist in Form von löslichen Salzen vor, die oft mit Partikeln, Schwebstoffen oder organischem Material aus biologischen Quellen verbunden sind. Sein Verhalten im Wasser wird durch Prozesse wie Adsorption, Ausfällung und Komplexbildung bestimmt, die von Faktoren wie pH-Wert, Ionenstärke, Metall- und Ligandenkonzentrationen und Festkörperoberflächen beeinflusst werden.
Unter sauerstoffarmen Bedingungen ist der Nickelgehalt aufgrund der Bildung von Nickelsulfid gering. Unter sauerstoffhaltige Bedingungen und bei einem pH-Wert unter 9 bildet Nickel lösliche Verbindungen, die die Nickelionenkonzentration über 60 mg L-1 halten. In natürlichen Gewässern (pH 5-9) ist die vorherrschende Form ein hydratisiertes Nickel-Ion, d.h. ein Molekül bestehend aus einem Nickel-Ion und angelagerten Wassermolekülen.
Einige Nickelverbindungen sind gut löslich (z. B. Nickelchlorid und Nickelsulfat), während andere eine geringere Löslichkeit aufweisen (z. B. Nickelnitrat und Nickelhydroxid). Nickelcarbonat ist am wenigsten löslich, und hydratisierte Nickel-Ionen sind die häufigste Nickelverbindung im Wasser.
Der größte Teil des freigesetzten Nickels reichert sich im Boden an und bindet sich stark an verschiedene Spezies wie Eisen- und Manganoxide sowie an andere Mineralien. Bodeneigenschaften wie Schüttdichte, pH-Wert, Textur, organische Stoffe, Tonminerale und Hydroxide sowie die Grundwasserströmung beeinflussen die Nickeladsorption und machen sie standortspezifisch.
In sauren Böden ist Nickel mobiler, während seine Adsorption in alkalischen Böden unumkehrbar ist und seine Verfügbarkeit und Mobilität einschränkt .
Nickel ist in allen Umweltkompartimenten weit verbreitet. Je nach den vorherrschenden Bedingungen tritt Nickel in verschiedenen Formen auf, die das weitere Schicksal bestimmen. Weitere Forschung ist erforderlich, um die ökologischen Auswirkungen insbesondere von Nickel-Nanopartikeln und deren Verbleib in aquatischen Ökosystemen umfassend zu bewerten, wobei verschiedene Umweltmedien und Organismen mit unterschiedlichen ökologischen Eigenschaften zu berücksichtigen sind.
 >
>