Aluminiumoxid ist hart und temperaturbeständig. Man verwendet es gerne für Schleifmittel, Knochenersatz, Schmelztiegel und Uhrengläser und eine Vielzahl weiterer Anwendungen. Bei Sodbrennen ist Aluminiumoxid ein bewährtes Mittel: Es hilft, die Magensäure ins Gleichgewicht zu bringen.
Wie könnte ich damit in Kontakt kommen?

Schleifpapier © Olivier-Le-Moal / fotolia.com
Als Schleifmittel (z.B. in Schleifpapier, dort meist als Korund bezeichnet) kann Aluminiumoxid stauben und dabei eingeatmet werden. Deshalb sollte man eine Atemschutzmaske tragen und/oder eine Absaugvorrichtung einsetzen. Jedoch: Aluminiumoxid-Nanopartikel verklumpen an (feuchter) Luft schnell, es wird also weniger Staub daraus gebildet, der eingeatmet werden könnte.
Aluminiumoxid gelangt in den Magen, wenn man entsprechende Tabletten gegen Sodbrennen einnimmt.
In Uhrgläsern, Tiegeln und weiteren Keramiken ist Aluminiumoxid fest gebunden, Nanopartikel werden im täglichen Gebrauch nicht frei. Es können keine Nanopartikel in den Körper gelangen.
Wie gefährlich ist das Material für Mensch und Umwelt?
Aluminiumoxide gehören zu den ungefährlicheren Substanzen. Nur in großen Mengen wirken sie giftig.
Obwohl man das Einatmen aller Stäube, auch von Aluminiumoxid, vermeiden sollte, sind keine außergewöhnlichen Schädigungen der Lunge nachgewiesen worden. Beim Verschlucken sind Aluminiumoxid-Nanopartikel nicht giftig. Tabletten gegen Sodbrennen oder andere Medikament auf Aluminiumbasis dürfen jedoch nur über kurze Zeiträume eingenommen werden. Ansonsten kann ein erhöhter Aluminiumspiegel im Blut zu gesundheitlichen Nebenwirkungen führen.
Fazit:
Im Alltag kommt der menschliche Körper nur mit geringen Mengen an Aluminiumoxid-Nanopartikeln in Kontakt; dadurch besteht keine Gefährdung der Gesundheit.
Nebenbei
- Reine Aluminiumoxid-Nanopartikel passieren nicht die Blut-Hirn-Schranke.
- Gelöste Aluminiumsalze im Blut erhöhen nicht das Alzheimerrisiko.
Eigenschaften und Anwendungen

0,2 µm dünne Deck-Membran aus amorphen Aluminiumoxid auf ca. 1 µm dicker Zwischenschicht aus gamma-Al2O3 © Dr. Andreas Krell, Fh-IKTS
Verbindungen des Aluminiums (Al) mit Sauerstoff (O) bezeichnet man als Aluminiumoxide, Verbindungen mit OH-Gruppen als Hydroxide. Aluminiumoxide (Al2O3) treten in verschiedenen Modifikationen auf, eines der bekanntesten und bedeutendsten ist alpha-Al2O3 (Korund). Daneben existieren eine Reihe weiterer Aluminiumoxide unterschiedlicher Struktur, die sogenannten Übergangstonerden [1,2]. Korund weist eine Dichte von 3,98g/cm³, eine hohe Härte, einen Schmelzpunkt von 2053 °C sowie einen hohen spezifischen elektrischen Widerstand von ca. 1012Ohm·m (bei 20°C) auf [3]. Es ist chemisch sehr stabil und in Wasser, Säuren und Laugen nahezu unlöslich, während sich z. B. die Übergangstonerde gamma-Al2O3 in starken Säuren und Basen löst. Gamma-Aluminiumoxid findet auf Grund seiner hohen Oberflächenaktivität als Adsorbenz und Katalysatormaterial Anwendung.
Neben den Oxiden des Aluminiums, kommen auch noch verschiedene Hydroxide vor. So gibt es die Aluminiumhydroxide [Al(OH)3] Bayerit und Gibbsit sowie die sogenannten Aluminiumoxihydroxide [AlO(OH)] Böhmit und Diaspor. Gibbsit, Böhmit und Diaspor sind Bestandteil des technisch wichtigsten Aluminiumminerals Bauxit.
Korund wird auf Grund seiner hohen Härte als Lagerstein in Uhren sowie als Schleif- und Poliermittel von Edelsteinen, Metallen und Si-Wafern verwendet. Mit Bindemitteln, insbesondere anderen Oxiden gemischt, wird Korundpulver zu Tiegeln, Schalen, Schutzrohren, elektrischen Isolatoren, Gelenkersatz (künstliches Hüft- oder Kniegelenk), Dentalkeramik, Brennerrohren, Katalysatorträgern, Verschleißschutz, Panzerungen, Ofenauskleidungen sowie Werkzeugen für die Umformung und Zerspanung von Metallen verarbeitet.
Korund ist zwar hart und spröde, weist aber eine geringe Zähigigkeit auf. Zur Steigerung der Zähigkeit setzt man dem weißen Korund für verschiedene Anwendungen teilstabilisiertes Zirkoniumoxid bzw. Titancarbid („Schwarze Keramik“) zu. Die geringe elektrische Leitfähigkeit und hohe Durchschlagfestigkeit von Aluminiumoxid nutzt man bei der Herstellung von Isolatoren und Zündkerzen.
Synthetische Korundkristalle werden aus Korundschmelzen gezüchtet und weisen hohe Härte, Transparenz und Kratzfestigkeit auf. Die Edelsteine Saphir und Rubin stellen Korund mit geringen Zusätzen von Eisen/Titan bzw. Chrom dar und werden, synthetisch hergestellt, z. B. in Lasern eingesetzt. Saphir findet z. B. als kratzfestes Uhrenglas Verwendung. Sinterkorund kann durch geringe Zusätze an Fremdstoffen ein breites Farbspektrum annehmen.
Böhmit und andere Aluminiumoxide dienen in der Erdöl- und chemischen Industrie wegen Ihrer thermischen Beständigkeit als Katalysatorträger und Adsorbentien. Nanoskaliges Aluminiumoxid kann, zu porösen Strukturen versintert und auf einem gröber strukturierten Träger aufgebracht, auch zur Nanofiltration eingesetzt werden.
Aluminiumhydroxid Al(OH)3 dient in Pulverform als Flammschutzmittel sowie als Füllstoff in Teppichbelägen, Gummi, Kunst- und Schaumstoffen. Weiterhin wird es in Zahnputzmitteln und Kosmetika eingesetzt.

Sinter-Korund kann durch geringe Zusätze an Fremdstoffen ein breites Farbspektrum annehmen. © Dr. Andreas Krell, Fh-IKTS
Im Allgemeinen dienen Aluminiumoxide und -hydroxide in der Farb- und Kunststoffindustrie als Verdickungs- und Füllmittel und werden auch zum Herabsetzen der Klebrigkeit und Erhöhen der Kratzfestigkeit eingesetzt. Auch die Farbbrillanz von Lacken kann positiv beeinflusst werden.
Alumimiumoxid ist als nanometergroßes Pulver nicht selbstentzündlich. Auch als fein verteilte Mischung mit Luft (Staub) unter Einwirkung einer Zündquelle ist Aluminiumoxid nicht entzündlich, also besteht keine Möglichkeit einer Staubexplosion.
Weitere Anwendungsbereiche finden sich in:
- Keramiken: hier auch oftmals hohe Abriebfestigkeit und Feuerfestigkeit
- Additiven für die Papierherstellung: Nicht-Haftung des Papiers in Hochgeschwindigkeitsprozessen an den Transportrollen
- Künstlichen Edelsteinen wie Saphiren oder Yttrium-Aluminium Granat (z.B. Einsatz in Hochenergielasern)
- Leuchtstoffen und Phosphoren: Aluminiumoxide als Trägermaterialien
Vorkommen und Herstellung
Aluminiumoxid wird großtechnisch aus dem Mineral Bauxit hergestellt. Die weltweiten Bauxitvorkommen werden auf ca. 20 Mrd. Tonnen geschätzt, die jährliche Weltfördermenge beläuft sich auf ca. 100 Millionen Tonnen. Australien weist die größten Vorkommen und die größte Fördermenge auf. Die sicherlich optisch schönste, aber auch seltene Modifikation des Aluminiumoxids ist der Saphir, der als Edelstein bekannt ist.
Die Herstellung von Aluminium und Aluminiumoxid erfolgt nach dem Bayer-Verfahren, bei dem Bauxit zerkleinert, getrocknet und mit konzentrierter Natronlauge gelöst wird. Die Verunreinigungen Eisen, Silizium und Titan werden im sogenannten Rotschlamm abgetrennt. Aus der Lösung wird Aluminiumhydroxid ausgefällt, das bei 1200-1300°C zu Al2O3 gebrannt wird.
NanoCare - Datenblätter
- Boehmit Datenblatt Nr.1 (PDF)
- Boehmit Datenblatt Nr.2 (PDF)
Weiterführende Informationen:
- Wefers, K and Misra, C (1987). Oxides and Hydroxides of Aluminum, Alcoa Technical Paper No. 19, Alcoa Laboratories, Pittsburgh, PA, 1987.
- Petzold, A and Ulbricht, J (1991). Aluminiumoxid: Rohstoff, Werkstoff, Werkstoffkomponente, Dt. Verl. Für Grundstoffind., Leipzig, 1991. ISBN 9783342005322.
- Alfrey, AC et al. (1976), N Engl J Med, 294(4): 184-188.
Aluminium kommt in Form von Aluminium-Ionen als natürlicher Bestandteil in Trinkwasser und anderen Lebensmitteln, insbesondere in Früchten und Gemüse, vor. Aluminiumoxid-Partikel agglomerieren stark, bilden also größere "Partikelhaufen". Sie sind in dieser Form für Zellen wenig toxisch.
Allgemeine Gefährdung
Zusätzliche Belastungsquellen können aluminiumhaltige Bedarfsgegenstände für Lebensmittel wie Kochutensilien, Dosen, Folien oder Tuben sein, aus denen das Leichtmetall in gelöster, ionischer Form auf die Speisen übergeht. Aluminiumverbindungen können außerdem in Medikamenten zur Neutralisation der Magensäure, so genannten Antacida, und in kosmetischen Mitteln enthalten sein. In Deo-Rollern werden sie beispielsweise wegen seiner schweißhemmenden Wirkung eingesetzt.
Im Vergleich zur Aufnahme über Lebensmittel oder Antacida ist die Aufnahme von Aluminium über Lebensmittelbedarfsgegenstände und kosmetische Mittel gering. Sie liegt deutlich unter der Aufnahmemenge, die aufgrund einer aktualisierten Bewertung der Welternährungs- und der Weltgesundheitsorganisation (JECFA, 2006) als gesundheitlich unbedenklich gilt.
Arbeitsmedizinische Untersuchungen zur Belastung und Beanspruchung in der aluminiumpulverherstellenden Industrie haben gezeigt, dass feinstes Aluminiumpulver unter ungünstigen arbeitshygienischen Bedingungen Lungenfibrosen verursachen kann. Diese auch als Aluminiumstaublunge bezeichnete Erkrankung kann seit 1943 in Deutschland als Berufskrankheit anerkannt und entschädigt werden [1,2].
Die Senatskommission der Deutschen Forschungsgemeinschaft legte einen zulässigen Grenzwert für die maximale Arbeitsplatzkonzentration (MAK-Wert) von Aluminiumoxiden von 1,5 mg/m3 fest. Arbeiter in der aluminiumpulververarbeitenden Industrie oder Schweißer in der Automobilindustrie müssen daher geeigneten Atemschutz tragen [3].
Ein Zusammenhang zwischen einer erhöhten Aluminiumion-Aufnahme aus Lebensmitteln inklusive Trinkwasser, Medikamenten oder kosmetischen Mitteln und einer Alzheimer-Erkrankung wurde bisher wissenschaftlich nicht belegt. Weder bei Dialyse-Patienten, noch bei Aluminium-Arbeitern - beides Personengruppen, die in großem Umfang mit Aluminium in Kontakt kommen - wurden die für Alzheimer typischen Amyloid-Ablagerungen im Gehirn überdurchschnittlich oft beobachtet [4].
Literatur
- DocCheck Flexicon (DE): Aluminose (Stand letzter Zugang: Okt 2010).
- BAuA Schriftenreihe (1994). Arbeitsmedizinische Untersuchungen zur Belastung und Beanspruchung in der aluminiumpulverherstellenden Industrie. 1. Auflage. Bremerhaven: Wirtschaftsverlag NW Verlag für neue Wissenschaft GmbH 1994, ISBN: 3-89429-551-1.
- Kraus, T et al. (2000), Int Arch Occup Environ Health, 73(1): 61-64.
- BFR-Stellungnahme Nr.33/2007 (22.07.2007): „Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen“ (PDF )
Untersuchungen am lebenden Organismus - in vivo
Im Projekt NanoCare wurden zwei verschiedene Böhmit-Partikelarten (Primärpartikel -Größen von 10 und 40nm) mittels in vivo Studien sehr intensiv untersucht. Die Experimente, bei denen Ratten über 4 Wochen an 5 Tagen der Woche bis zu 28mg/m3 der Partikel einatmeten, zeigten, dass nur bei der höchsten Konzentration Entzündungen der Lungen durch die stark verklumpten Partikel auftraten. Außerdem wurden vermehrt vergrößerte Fresszellen und Veränderungen an den Lymphknoten beobachtet [1,2,3]. Wurden mehr als 1mg Partikel pro Lunge von den Ratten inhaliert, führte dies zu Entzündungen in den Lungen.
Ähnliche Ergebnisse zeigten die im Projekt durchgeführten Instillationsversuche. Wurden hierbei mehr als 1,2mg Böhmitpartikel pro Lunge in die Atemwege eingeflößt, zeigten die Lungen der Versuchstiere Schädigungen. Der NO(A)EL liegt in diesen Studien bei 0,6mg [1].
Literatur
- NanoCare 2009, Final Scientific Report, ISBN 978-3-89746-108-6. (PDF-Dokument, 19 MB )
- Pauluhn, J (2009), Toxicol Sci, 109(1): 152-167.
- Pauluhn, J (2009), Toxicology, 259(3): 140-148.
Untersuchung außerhalb des Körpers – in vitro
Untersuchungen mit Al-, Al2O3- und AlOOH- (Böhmit)-Partikeln zeigten, dass diese Partikel zu starken Verklumpungen, also zu Agglomeraten neigen. Diese Agglomerate können in die Zellen aufgenommen werden, sind aber stets in Vesikeln, also nicht frei in den Zellen und praktisch nie im Zellkern zu finden [2,3,4,6]. Untersuchungen an menschlichen Lungenzellen zeigten, dass Al2O3 geringe schädliche Effekte auf die Zellteilung und Zellvitalität hat, dass selbst bei sehr hohen Dosen keine für die Zellen schädlichen Sauerstoffradikale (ROS) auftraten [7].
Aluminiumoxid (Al2O3), das z.B. in orthopädischen Keramiken Verwendung findet, wurde auch auf Genotoxizität hin untersucht. Eine erbgutschädigende Wirkung trat nur in sehr geringem Ausmaße nach Zugabe sehr hoher Dosen auf. Dabei wirken Aluminiumoxid-Fasern eher genotoxisch als nano- oder mikroskalige Partikel [1]. Aluminium Partikel sind giftiger als Aluminiumoxid-Partikel [4]. Nur in sehr hoher Dosierung vermindertAl2O3 die Funktion der Mitochondrien (erst bei 200µg/ml Verminderung der Mitochondrien-Funktion um 15%), und führt bei einem Teil der Zellen den (programmierten) Zelltod herbei [5,6].
Im Projekt NanoCare wurde Böhmit, ein Aluminiumoxihydroxid (AlOOH) untersucht. Dabei wurde für die humane Lungenzelllinie A549 eine Schwellenkonzentration von mindestens 50µg Partikeln pro Quadratzentimeter Zellrasen bestimmt. Erst ab dieser Konzentration (LOEL) und einer Behandlung über 72h wurde beobachtet, dass die Zellen in Stress versetzt und Entzündungsmarker produziert wurden. Wurde AlOOH niedrig dosiert verwendet, konnten bei verschiedenen Zelllinien unterschiedlicher Herkunft keine Effekte ausgelöst werden [2]. Experimente zur Mobilität von Nanopartikeln über Zellbarrieren (wie z.B. die Luft-Blut Barriere in der Lunge) legten dar, dass Böhmit nicht durch die Zellen hindurch geht. Die Barrierefunktion der Zellen wird durch die Partikel nicht beeinflusst.
Mit Hilfe des sogenannten Vektor-Models, das einige der elementaren Zelleffekte abbildet [8], konnten Partner des NanoCare-Projektes zeigen, dass unter allen getesteten Materialien AlOOH zu den Partikeln mit geringer Toxizität zählt. Eine Konzentration von 60-120 µg Partikeln pro 106 Fresszellen (damit sind die Zellen schon völlig überladen) führte eine Schädigung der Zellen herbei, wobei auch bei dieser hohen Dosis keine schädlichen Sauerstoffradikale (ROS) in den Zellen detektiert wurde [2]. Eine Schädigung durch realitätsnahe Dosen an Al-Partikeln ist nicht zu erwarten.
Literatur
- Tsaousi, A et al. (2010), Mutat Res, 697(1-2): 1-9.
- NanoCare 2009, Final Scientific Report, ISBN 978-3-89746-108-6. (PDF-Dokument, 19 MB ).
- Monteiro-Riviere, NA et al. (2010), J Appl Toxicol, 30(3): 276-285.
- Wagner, AJ et al. (2007), J Phys Chem B, 111(25): 7353-7359.
- Jeng, HA et al. (2006), J Environ Sci Health A Tox Hazard Subst Environ Eng, 41(12): 2699-2711.
- Simon-Deckers, A et al. (2008), Toxicology, 253(1-3): 137-146.
- Kim, I-S et al. (2010), J Nanosci Nanotechnol, 10(5): 3453-3458.
- Bruch, J et al. (2004), Int J Hyg Environ Health, 207(3): 203-216.
Aluminium kommt natürlich in der Erdkruste vor (ca. 8,1 g/kg Boden) und verschiedene Aluminiumverbindungen sind Bestandteile von Böden und Gestein. Für nanoskalige Aluminiumoxide gibt es keine Messwerte für tatsächliche Umweltkonzentrationen.
Aus der Menge der in verschiedenen Konsumgütern eingesetzten Al2O3-Partikeln wurden mittels Computermodellen Konzentrationen von 0,0002g/l in Wasser bzw. 0,01g/kg im Boden vorhergesagt [1]. Im Vergleich zum natürlichen Vorkommen von Aluminium im Boden und auch zu vorhergesagten Umwelt-Konzentrationen (PEC Wert) für Zinkoxid- oder Titandioxid-Nanopartikeln sind diese Werte sehr gering.
Literatur
- Tiede, K et al. (2009), J Chromatogr A, 1216(3): 503-509.
Die Inhalation von feinstem Aluminiumoxidstaub kann zu Entzündungen der Lunge führen. Im Gegensatz zur Lunge ist die Haut eine gute Barriere gegen Partikel. Aluminium kommt als natürlicher Bestandteil, als Aluminiumsalz, in Trinkwasser und anderen Lebensmitteln, insbesondere in Früchten und Gemüse vor.
Aufnahme über die Lunge - Inhalation
Eine dauerhafte Exposition mit Aluminiumoxiden kann zu Schädigungen der Lunge, einer Aluminium(oxid)staublunge (Aluminose) führen. Unter einer Aluminose versteht man die krankhafte Veränderungen der Lunge, die durch eine chronische Exposition gegenüber Aluminiumrauch bzw. Aluminiumoxidstaub (da reines Aluminium an Luft sofort oxidiert und dadurch mit einer hauchdünnen Aluminiumoxidschicht überzogen ist, handelt es sich also um Aluminiumoxid-Partikel) entstehen kann. Die Aluminose gehört zu den Pneumokoniosen und ist eine entschädigungspflichtige Berufskrankheit.
Arbeiter in der aluminiumpulververarbeitenden Industrie oder Schweißer in der Automobilindustrie müssen daher geeigneten Atemschutz tragen. Beim Ab- und Umfüllen der Pulver sollte eine Staubentwicklung vermieden werden. Für gute Belüftung/Absaugung am Arbeitsplatz ist ebenfalls zu sorgen. Die maximale Arbeitsplatzkonzentration (MAK-Wert) an Aluminiumoxide darf 1,5 mg/m3 (alveolengängige Fraktion) betragen.
Literatur
- DocCheck Flexikon (DE): Aluminose (Stand letzter Zugang: Dez 2010).
- BAuA Schriftenreihe (1994). Arbeitsmedizinische Untersuchungen zur Belastung und Beanspruchung in der aluminiumpulverherstellenden Industrie. 1. Auflage. Bremerhaven: Wirtschaftsverlag NW Verlag für neue Wissenschaft GmbH 1994, ISBN: 3-89429-551-1.
- Kraus, T et al. (2000), Int Arch Occup Environ Health, 73(1): 61-64.
- Chemikalienlexikon.de: Sicherheitsdatenblatt Aluminium (Stand 2010).
Aufnahme über die Haut – Dermal
Aluminium(salze) werden in Deorollern wegen ihrer schweißhemmenden Wirkung eingesetzt. Al2O3, das nach der OECD Richtlinie 404 (engl. Acute Dermal Irritation/Corrosion) [3] in Tierversuchen getestet wurde, verursachte keine Hautreizung bei den Versuchstieren. Die maximal empfohlene tägliche Aufnahmemenge von Aluminiumionen durch die Verwendung von Deorollern liegt bei 7 µg und wird als gesundheitlich unbedenklich angesehen [2].
Literatur
- Chemikalienlexikon.de: Sicherheitsdatenblatt Aluminium (Stand 2010).
- BFR-Stellungnahme Nr.33/2007: „Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen“ (PDF )
- OECD (2015), Test No. 404: Acute Dermal Irritation/Corrosion, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, https://doi.org/10.1787/9789264242678-en.
Aufnahme über den Magen-Darm-Trakt
Vom gemeinsamen Expertengremium für Lebensmittelzusatzstoffe der Welternährungsorganisation (FAO) und der WHO (JECFA) und dem wissenschaftlichen Lebensmittelausschuss der EU-Kommission (SCF) wurde 1989 ein vorläufiger, tolerierbarer wöchentlicher Aufnahmewert in Höhe von 7 mg/kg Körpergewicht für die Gesamtaufnahme von Aluminium(ionen) aus Lebensmitteln, einschließlich Aluminiumsalzen in Lebensmittelzusatzstoffen abgeleitet [3,4].
Erst sehr viel höhere Dosen führen zu Vergiftungen. Nach Verschlucken von Al2O3 liegt die Toxizität (LD50) bei 5 g/kg Körpergewicht (Ratte) [1]. Das heißt, ein erwachsener Mensch mit 70 kg Körpergewicht müsste also mind. 350 g Al2O3 zu sich nehmen. Ernsthafte Störungen, wie Schleimhautreizungen, treten aber schon beim Verschlucken von 4 g auf. Aluminiumoxid ist über den Magendarmtrakt nur wenig resorbierbar. Aluminiumverbindungen werden hauptsächlich über die Nieren ausgeschieden [2].
Literatur
- Chemikalienlexikon.de: Sicherheitsdatenblatt Aluminium (Stand 2010)
- BFR-Stellungnahme Nr.33/2007: „Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen“.
- Joint FAO/WHO Expert Committee on Food Additives (JECFA) (1989). Toxicological evaluation of certain food additives and contaminants. WHO Food Additives Series 24: 113-154.
- World Health Organisation (WHO) (2011). Guidelines for drinking-water quality, fourth edition. ISBN: 978 92 4 154815 1
Die Wirkung von nano- und mikroskaligem Aluminiumoxiden wurde in einer Vielzahl von Organismen untersucht, wobei nur sehr hohe, häufig nicht umweltrelevante Konzentrationen eine toxische Wirkung aufwiesen.
So wurden die Boden-bewohnenden Modellorganismen, wie Schlammröhrenwurm, Flohkrebs, Regenwurm und Körbchenmuschel untersucht [1]. In dieser Studie zeigte lediglich der Flohkrebs bei sehr hohen, nicht umweltrelevanten Konzentrationen von nanoskaligem Al2O3 eine Beeinträchtigung von Wachstum und Überleben. Hinsichtlich der Aufnahme von Aluminium wurden große Unterschiede sowohl zwischen Organismen als auch zwischen nano- und mikroskaligem Al2O3 beobachtet.

Der Schlammroehrenwurm. © Wikipedia.de
Für einen Fadenwurm war Al2O3 toxisch, nachgewiesen durch eine Wachstumshemmung und Einschränkung der Reproduktion [2]. Hier wirkten Nanopartikel stärker als gröbere Partikel. Interessanterweise konnte für ein Aluminiumsalz eine noch stärkere Toxizität als für die Nanopartikel nachgewiesen werden. Eine Regenwurmart, die gegenüber Al2O3 in der Erde für 4 Wochen exponiert wurde, zeigt auch in sehr hohen, nicht in der Umwelt anzutreffenden Konzentrationen keine erhöhte Sterblichkeit. Die Würmer waren jedoch in ihrer Fortpflanzung beeinträchtigt [3].
Nanoskaliges Aluminiumoxid weist keine starken antimikrobiellen Eigenschaften auf. Die Stoffwechselaktivität von Bakterien wurde durch Al2O3-Partikel nicht beeinflusst [4,5]. Sehr hohe Partikel-Konzentrationen, die nicht in der Umwelt zu erwarten sind, führten durch eine Interaktion mit der Bakterienoberfläche zu einer leichten Reduzierung des bakteriellen Wachstums [6]. Im Gegensatz dazu stehen Ergebnisse, die eine starke Einschränkung des Wachstums verschiedener Bakterienarten in auch geringeren Konzentrationen zeigen [7,8]. Zudem wurde auch hier ein stärkerer Effekt der Nanopartikel verglichen mit größeren Partikeln festgestellt. Nanoskaliges Al2O3 löst keine mutagenen Effekte aus [9].
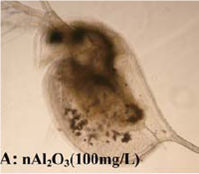
Ein Wasserfloh mit Aluminiumoxid Nanopartikeln im Körper. © Zhu et al 2009
Wasserflöhe reagierten auf eine Exposition mit sehr hohen Konzentrationen von Al2O3-Nanopartikeln mit einer verringerten Beweglichkeit und erhöhten Sterblichkeit [10,11]. Wie in der Abbildung zu erkennen, nehmen die Wasserflöhe die Nanopartikel aus dem Wasser in den Darm auf. Es wurde eine erhöhte Empfindlichkeit gegenüber nanoskaligen verglichen mit mikroskaligen Partikeln beobachtet [10]. Für Embryonen und Larven des Zebrabärblings hingegen waren weder nano- noch mikroskalige Partikel toxisch [12,13].
Verschiedene Pflanzen wie die Kalifornische Kidneybohne und das Weidelgras zeigten in Gegenwart von nanopartikulärem Al2O3 normales Wachstum. Kidneybohnen nahmen keine Partikel aus dem Boden in die Blätter auf, während sich die Aluminiumkonzentration in den Blättern des Weidelgrases ungefähr verdoppelte [14]. Ebenfalls keinerlei toxische Effekte durch Aluminiumoxid wurden auf Keimung, Wurzelwachstum und Blattanzahl der Ackerschmalwand (Arabidopsis) beobachtet [13]. Mais, Karotten, Soja, Kohl und Gurke zeigten in Gegenwart von Al2O3 ein vermindertes Wurzelwachstum [15]. Interessanterweise verschwand dieser Effekt, wenn die Partikel vorher mit Phenanthren beladen wurden. Es wird spekuliert, dass das Phenanthren bestimmte Oberflächeneigenschaften der Partikel so verändert, dass diese nicht mehr toxisch wirken. Rettich, Raps, Roggen, Salat, Mais und Gurke waren in einer anderen Studie hingegen nicht in Keimung und Wurzelwachstum beeinflusst [16]. Bei Algen wurde ebenfalls keine Toxizität beobachtet [5].
Das Risiko für Umweltorganismen durch Al2O3-Nanopartikel wird als gering eingeschätzt. Aufgrund der geringen oder nicht vorhandenen Toxizität werden häufig keine Unterschiede zwischen nano- und mikroskaligen Partikel beobachtet. Tritt jedoch ein stärkerer toxischer Effekt auf, so ist dieser für nanoskalige Partikel ausgeprägter als für mikroskalige.
Literatur
- Stanley, JK et al. (2010), Environ Toxicol Chem, 29(2): 422-429.
- Wang, H et al. (2009), Environ Pollut, 157(4): 1171-1177.
- Coleman, JG et al. (2010), Environ Toxicol Chem, 29(7): 1575-1580.
- Doshi, R et al. (2008), Environ Res, 106(3): 296-303.
- Velzeboer, I et al. (2008), Environ Toxicol Chem, 27(9): 1942-1947.
- Sadiq, IM et al. (2009), Nanomedicine, 5(3): 282-286.
- Jiang, W et al. (2009), Environ Pollut, 157(5): 1619-1625.
- Hu, X et al. (2009), Sci Total Environ, 407(8): 3070-3072.
- Pan, X et al. (2010), Chemosphere, 79(1): 113-116.
- Zhu, X et al. (2008), J Nanopart Res, 11(1): 67-75.
- Griffitt, RJ et al. (2008), Environ Toxicol Chem, 27(9): 1972-1978.
- Zhu, X et al. (2008), J Environ Sci Health A Tox Hazard Subst Environ Eng, 43(3): 278-284.
- Harper, S et al. (2008), J Exp Nanosci, 3(3): 195-206.
- Lee, CW et al. (2010), Environ Toxicol Chem, 29(3): 669-675.
- Yang, L et al. (2005), Toxicol Lett, 158(2): 122-132.
- Lin, D et al. (2007), Environ Pollut, 150(2): 243-250.
Sowohl Aluminiumpartikel als auch Aluminiumoxidpartikel werden in Zellen aufgenommen. Wenn sie nicht mit Hilfsstoffen stabilisiert werden, neigen sie zum Verklumpen.
Verhalten an der Blut-Hirn-Schranke
Um die Durchlässigkeit der Blut-Hirnschranke zu untersuchen, werden Tierversuche mit Mäusen und Ratten durchgeführt. In einer Studie wurden den Versuchstieren dabei sehr hohe Dosen an Aluminium-Partikeln über die Halsschlagader, in die Venen, in den Bauchraum oder direkt in die Hohlkörper des Gehirns verabreicht [1]. Unter realitätsnahen Bedingungen können aber die in diesen Experimenten verwendeten Dosen nicht erreicht werden. Deshalb müssen die Ergebnisse mit Vorsicht interpretiert werden. Eine durch Aluminium-Nanopartikel verursachte Neurotoxizität konnte unter Verwendung von relevanten Dosen bislang nicht nachgewiesen werden [2,3].
Literatur
- Sharma, HS et al. (2009), J Nanosci Nanotechnol, 9(8): 5055-5072.
- Oberdoerster, G et al. (2009), J Nanosci Nanotechnol, 9(8): 4996-5007.
- BFR-Stellungnahme Nr.33/2007: „Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen“ (PDF, ).
Aufnahmeverhalten in Zellen
Auch diese Agglomerate können in die Zellen aufgenommen werden, sind aber stets in Vesikeln, nicht frei in den Zellen und praktisch nie im Zellkern zu finden. Agglomerierte Partikel können mittels Elektronenmikroskopie in den Zelleinschlüssen nachgewiesen werden. Die Vesikelmembran schützt die restlichen Zellkomponenten vor den Partikeln [1,2,3,4].
Literatur
- NanoCare 2009, Final Scientific Report, ISBN 978-3-89746-108-6. (PDF-Dokument, 19 MB ).
- Monteiro-Riviere, NA et al. (2010), J Appl Toxicol, 30(3): 276-285.
- Wagner, AJ et al. (2007), J Phys Chem B, 111(25): 7353-7359.
- Simon-Deckers, A et al. (2008), Toxicology, 253(1-3): 137-146.
Nur wenige Studien haben sich mit dem Verhalten von technisch hergestellten Aluminium-Nanopartikeln in der Umwelt beschäftigt. Generell ist die Löslichkeit dieser Partikel als gering einzuschätzen, d.h. nur wenige Ionen gelangen aus den Partikeln in wässrige Lösung [1]. Unter sauren Bedingungen erhöht sich allerdings die Löslichkeit, es gelangen mehr Ionen in Boden oder Wasser, welche als toxisch für die Wurzeln von Nutzpflanzen beschrieben wurden.
In Böden sind Aluminium-Partikel beweglich, bei niedrigen, sauren pH-Werten ist die Mobilität deutlich höher [2]. In Gegenwart von natürlichem organischen Material verbleiben mehr Partikel in der Lösung; d.h. das organische Material beeinflusst die Stabilität einer Suspension aus Al2O3[1,3,4].

Aluminiumoxid Partikel aufgenommen mit dem Transmissionselektronen-Mikroskop (TEM). © Stanley et al. 2010
Untersuchungen zur Bindung verschiedener Chemikalien durch nanoskaliges Al2O3 ergaben, dass unterschiedliche Mengen gebunden werden und eine Toxizität dieser Chemikalien dadurch eher erniedrigt wird [5]. Gleichzeitig kann die Bindung von organischem Material aus Boden oder Wasser an Al2O3-Partikel die Menge von gebundenem Chemikalien (z.B. Phenanthren), verglichen mit organischem Material alleine oder Partikeln alleine erhöhen [6]. Die Auswirkungen der Chemikalienbindung durch Partikel auf Umweltorganismen sind noch nicht vollständig geklärt. Dabei ist jedoch anzumerken, dass die Bindung von organischem Material auch an natürlichen Aluminium-Partikeln erfolgt .
Literatur
- Stanley, JK et al. (2010),Environ Toxicol Chem, 29(2): 422-429.
- Doshi, R et al. (2008), Environ Res, 106(3): 296-303.
- Davis, JA et al. (1981), Environ Sci Technol, 15(10): 1223-1229.
- Ghosh, S et al. (2008), Langmuir, 24(21): 12385-12391.
- Ra, JS et al. (2008), Environ Int, 34(2): 184-192.
- Yang, K et al. (2010), Environ Sci Pollut Res Int, 17(2): 410-419.
 >
>