Unser Magen-Darm-Trakt ist hochspezialisiert, wenn es darum geht, Material (Nahrung) von außen aufzunehmen und diese in gebrauchsfertigen, zerkleinerten Einheiten über das Blut auf die Organe zu verteilen. Es besteht die Möglichkeit, dass auch Nanomaterialien diese Körperschranke durchdringen können. Es handelt sich jedoch um nur sehr kleine Mengen, deren Wirkung bisher als unbedenklich eingestuft wird.
Nahrung und Magen-Darm-Trakt
Unser Körper ist davon abhängig, dass wir möglichst täglich Wasser und Nahrung aufnehmen. In Notfällen können wir für mehrere Tage bis Wochen ohne Nahrung auskommen, allerdings nur wenn genügend Wasser zur Verfügung steht, denn Durst können wir nur für einige Tage überleben. Unsere feste Nahrung besteht dabei aus einem Gemisch aus pflanzlichen und tierischen Produkten. Diese setzen sich vornehmlich aus Zuckermolekülen, Fetten, Proteinen, DNA sowie Mineralien und Ballaststoffen zusammen. Die unterschiedlichen aufeinanderfolgenden Abschnitte unseres Magen-Darm-Traktes haben dabei die folgenden Aufgaben:
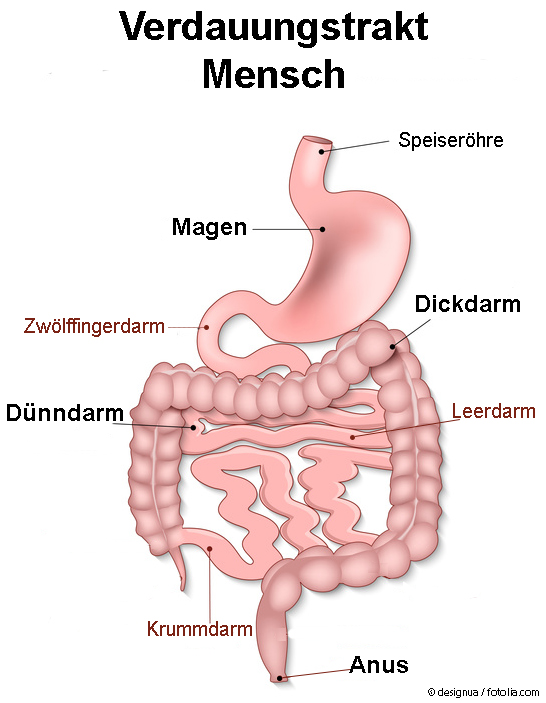
- Magen – Magen-Säure und Knetbewegungen der Magenmuskulatur helfen dabei, einen Nahrungsbrei herzustellen. Zusätzlich werden hier Bakterien und unerwünschte Eindringlinge abgetötet.
- Dünndarm – Hauptaufgabe ist die Aufbereitung des Nahrungsbreis und Aufnahme verschiedenster Nährstoffe in den Körper
- Zwölffingerdarm (lat. Duodenum) – Neutralisation des sauren Magenbreis & Zuleitung von Galle und Verdauungsenzymen, so dass alle Fette der Nahrung fein verteilt sind und damit für eine bessere Verdauung wasserlöslicher werden.
- Leerdarm (lat. Jejunum) – Spaltung in Einzelbausteine & aktive Aufnahme von Proteinen, Fetten, Zuckern und Vitaminen.
- Krummdarm (lat. Ileum) – aktive Aufnahme restlicher Nährstoffe (z.B. Vitamin B12) und Überleitung des Nahrungsbreis in den Dickdarm.
- Dickdarm – Eindicken des prozessierten Nahrungsbreis („Stuhl“) und Rückgewinnung von Wasser und lebenswichtigen Elektrolyten (Salze, Ionen)
- Anus – Kontrolle der Stuhlentleerung
Viele Mineralien und Ballaststoffe, die für die Verdauung und auch für unseren Körper wichtig sind, zählen zur Gruppe der partikel-förmigen Bestandteile und können auch in Nanogröße vorliegen.
Beispiele für mögliche Quellen von synthetischen Nanomaterialien sind:
- Nahrung, (Trink-)Wasser, aufbereitete Getränke: Zusatzstoffe wie Kieselsäure (chem. Siliziumdioxid) können auch Nanopartikel Anteile enthalten
- Medikamente: Zusatzstoffe wie Kieselsäure (chem. Siliziumdioxid) oder Titandioxid können auch Nanopartikel Anteile enthalten
- Medizinische Anwendungen von Nanomaterialien als Kontrastmittel
- Schleim aus der Lunge: eingeatmete Nanomaterialien können nach den Reinigungsprozessen der Lunge im Schleim enthalten sein und unabsichtlich verschluckt werden (vgl. Querschnittsartikel „Nanopartikel und Lunge„)
Nach geltendem Recht müssen alle synthetischen Bestandteile in der Nahrung von den Herstellern ebenso wie die generelle Zusammensetzung eines „produzierten Nahrungsmittels“ auf der Verpackung aufgeführt werden. Seit Dezember 2014 gilt in der EU eine besondere Kennzeichnungspflicht für Lebensmittel-Zusatzstoffe in Nano-Größe, die mit einem Zusatz „(nano)“ angegeben werden müssen (vgl. FAQ „Inhaltsstoffe Nano„).
Nanomaterialien im Magen
Der Magen besitzt eine besonders dicke Schleimhaut, die zudem noch von Binde- und Muskelgewebe umgeben ist. Deshalb können, abgesehen von ganz wenigen Ausnahmen wie Alkohol, keine Stoffe – auch keine Nanomaterialien – diese Barriere durchdringen. Die Magensäure ermöglicht es allerdings, dass im Mageninhalt enthaltene Nanomaterialien aus bestimmen Metallen (Kupfer oder Silber) oder auch einige Metalloxide (wie z.B. Kupferoxid oder Zinkoxid) teilweise oder sogar vollständig aufgelöst werden. Daher sind Simulationsversuche mit künstlicher Magensäure wichtig, um dies zu untersuchen.
Nanomaterialien im Darm
Der menschliche Darm besitzt bei einer Länge von ca. 6 Metern eine sehr große Oberfläche von ungefähr 100-200 m2, die Darmzotten miteingerechnet. Die Zotten wiederum sind mit einem Vielfachen an Mikrozotten (sogenannte Mikrovilli) bestückt, so dass sich die Oberfläche auf mehrere Hundert Quadratmeter vergrößert, was der Doppelspielfläche eines Tennisplatzes entspricht. Diese riesige Fläche ermöglicht einerseits die Aufnahme von niedermolekularen Stoffen wie Nährstoffen, Vitaminen sowie bestimmten Arzneimitteln aber auch von Giften und anderen unerwünschten Stoffen. Man geht davon aus, dass etwa 1012 bis 1014 Nanopartikel pro Tag über die Nahrung in den Magen-Darm-Trakt eines Menschen gelangen [1].
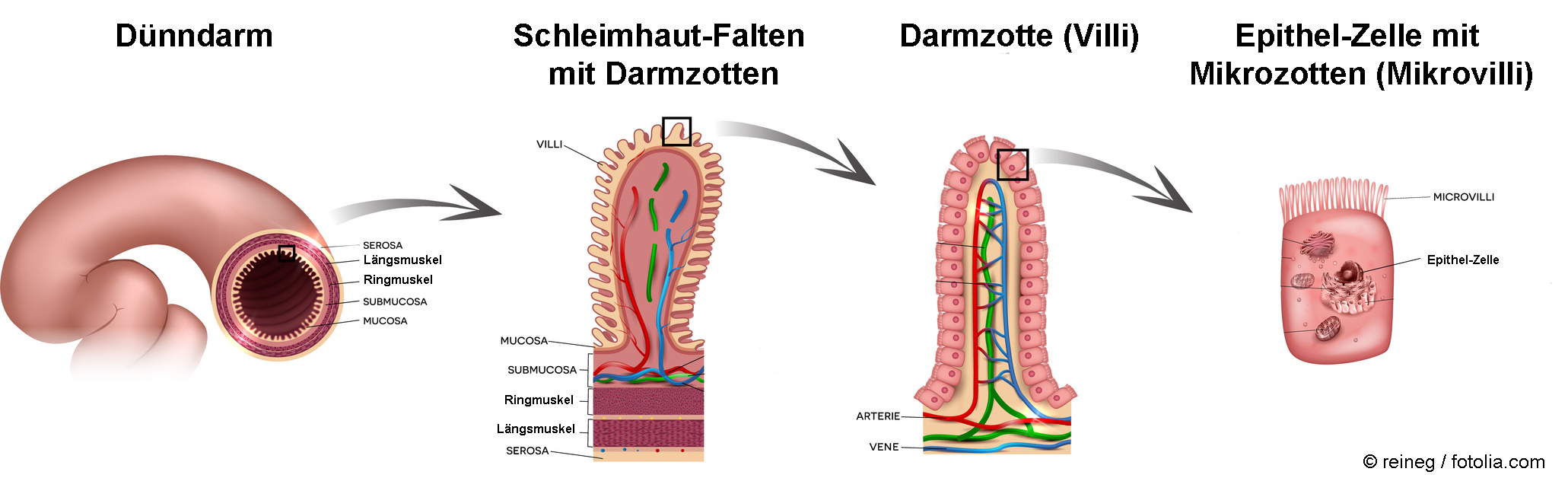
Kontrollierte Studien mit Freiwilligen haben gezeigt, dass mikro- und nanoskalige Titandioxid Partikel nur schlecht bis gar nicht über den Magen-Darm aufgenommen werden. Verabreichte Silber Nanopartikel wurden nur in geringen Mengen bis maximal 10 % der eingesetzten Menge aufgenommen ohne aber physiologische Effekte zu verursachen. Weiterhin werden Siliziumdioxid (Nano)-Partikel seit über 50 Jahren als wichtige Hilfsstoffe in Tabletten, sowie als Verdickungshilfsmittel in verschiedenen Nahrungsmitteln eingesetzt. Auch nanoskaliges Bariumsulfat, das in der Medizin als Kontrastmittel für Röntgenuntersuchungen zum Einsatz kommt, wird nicht aufgenommen sondern unverändert vom Körper wieder ausgeschieden [2-5].
Leicht lösliche Nanopartikel verursachen keine Partikel-bezogenen Toxizität, sondern können wie jedes Metallsalz auch zu einer erhöhten Exposition gegenüber Metallen führen und (in hohen Dosierungen) bekannte Metalleffekte nach sich ziehen (z.B. Kupfer-Vergiftung). Im Tiermodell hat sich gezeigt, dass sich Nanopartikel in speziellen Bereichen des Darms, den sogenannten Peyer’schen Plaques anreichern können [6-10]. Aktuell werden diese kleinen, im gesamten Dünndarm verteilten „Inseln des Immunsystems“ als Eingangspforte auch für Nanopartikel diskutiert. Allerdings sind bei allen bisherigen Studien die Aufnahmemengen für die im Versuch eingesetzten Nanopartikel im sehr niedrigen Prozent- bis Promillebereich [6,7,10,11].
Alles, was vom Körper nicht benötigt wird, verbleibt üblicherweise im Darm. Über die Nahrung aufgenommene Nanopartikel werden daher wie z.B. auch Ballaststoffe über den Stuhl wieder nach außen abgegeben.
Geschädigte Darmbarriere
Ist die Darmbarriere infolge von beispielweise entzündlichen Erkrankungen (z.B. Morbus Crohn, Colitis ulcerosa) in ihrer Funktion beeinträchtigt, ist es möglich, dass die Aufnahmerate für Nanopartikel höher liegt als vergleichsweise im gesunden Verdauungstrakt. Den Effekt, dass sich Nanopartikel in entzündlichen Darmabschnitten anreichern können, versucht man in der Medizin therapeutisch auszunutzen: Nanopartikel aus Poly-(Milch-co-Glycolsäure) wie auch aus Siliziumdioxid befinden sich daher in der Entwicklung als Träger für Arzneistoffe zur lokalen Therapie von derartigen entzündlichen Darmerkrankungen [12-15].
Der Magen-Darm-Trakt ist es gewohnt, mit „Fremdmaterial“ umzugehen, dennoch besteht die Möglichkeit, dass Nanopartikel z.B. aus der Nahrung auch durch die Darmwand gelangen können. Es handelt sich jedoch um nur sehr kleine Mengen, deren Wirkung bisher als unbedenklich eingestuft wird [11,16,17].
Literatur ![]()
- Lomer, MC et al. (2004), Br J Nutr, 92(6): 947-955.
- Kumar, N & Kumbhat, S (2016), Essentials in Nanoscience and Nanotechnology. Wiley & Sons, pp. 441. ISBN:9781119096122
- Jones, K et al. (2015), Toxicol Lett, 233(2): 95-101.
- Munger, MA et al. (2014), Nanomedicine, 10(1): 1-9.
- Scherer, D et al. (1993), J Drug Target, 1(1): 21-27.
- Nefzger, M et al. (1984), J Pharm Sci, 73(9): 1309-1311.
- Kreuter, J et al. (1989), Int J Pharm, 55(1): 39-45.
- Jani, PU et al. (1992), Int J Pharm, 86(2-3): 239-246.
- Hillery, AM et al. (1994), J Drug Target, 2(2): 151-156.
- Araujo, L et al. (1999), Int J Pharm, 176(2): 209-224.
- Yada, RY,et al. (2014), Compr Rev Food Sci Food Saf, 13: 730–744.
- Lamprecht, A et al. (2005), J Pharmacol Exp Ther, 315(1): 196-202.
- Schmidt, C et al. (2013), J Control Release, 165(2): 139-145.
- Moulari, B et al. (2008), Biomaterials, 29(34): 4554-4560.
- Hua, S et al. (2015), Nanomed – Nanotechnol Biol Med, 11(5): 1117-1132.
- Frohlich, E & Roblegg, E (2012), Toxicology, 291(1-3): 10-17.
- Bergin, IL & Witzmann, FA (2013), Int J Biomed Nanosci Nanotechnol, 3(1-2): 163-210.
 >
>