Cerdioxid in Form von Nanopartikeln kann als Autoabgaskatalysator hochgiftiges Kohlenmonoxid zu weniger schädlichem Kohlendioxid umwandeln. Die Halbleiterindustrie verwendet Nanopartikel aus Cerdioxid bei der Herstellung von Computerchips: Hier dienen sie als hochfeines Schleif- und Poliermittel, vergleichbar den winzigen Körnern auf feinem Schleifpapier.
Nicht nanoskaliges Cerdioxid verbessert in Glühstrümpfen von Gaslaternen die Lichtausbeute: Die reine Gasflamme gibt zwar kaum Licht ab, aber das glühende Cerdioxid leuchtet gelblich weiß.
Wie könnte ich damit in Kontakt kommen?

Auspuff © UFZ
Cerdioxid wird in manchen Autoabgaskatalysatoren und auch teilweise als Additiv von Kraftstoffen verwendet. Daher kann es in der Umgebungsluft vorhanden sein. Studien dazu findet man aber bislang nicht. Andere Quellen, aus denen Cerdioxid Nanopartikel stammen, sind nicht bekannt. Da Glühstrümpfe kaum noch produziert werden und dabei auch keine Nanopartikel verwendet werden, besteht hier ebenso wenig eine Kontaktmöglichkeit wie bei der Nutzung als Poliermittel in der Fertigung von Computerchips. Denn diese werden in hochisolierten Produktionsräumen hergestellt.
Hat das Material eine Wirkung auf Mensch und Umwelt?
Zur Wirkung von Cerdioxid Nanopartikel auf den Menschen weiß man noch wenig. In der Fachliteratur lassen sich sowohl Hinweise auf nützliche als auch auf schädliche Effekte finden. Von geringen Mengen scheint keine Gefahr auszugehen. Zudem nimmt man derzeit an, dass nur wenig nanoskaliges Cerdioxid in der Umwelt vorhanden ist.
Fazit
Zu Nanopartikeln aus Cerdioxid müssen weitere Untersuchungen durchgeführt werden, bevor eine gesicherte Aussage zu ihren Wirkungen gemacht werden kann. Derzeit läuft ein großes Projekt, das die Langzeitwirkungen von Cerdioxid Nanopartikel untersucht.
Nebenbei
Das Element Cer, das in Cerdioxid enthalten ist, gehört zu den Metallen der Seltenen Erden. Es bekam seinen Namen von dem Zwergplaneten Ceres, der im Asteroidengürtel zwischen Mars und Jupiter zu finden ist. Ob es Cer oder Cerdioxid auf Ceres gibt, ist nicht bekannt. Auch die im Februar 2015 bei Ceres eingetroffene NASA-Sonde Dawn konnte das nicht klären: Cer stand schlicht nicht auf dem Forschungsprogramm.
Eigenschaften und Anwendungen

Seltene Erden © chombosan / fotolia.com
Cerdioxid (CeO2) ist ein Oxid des Seltenerd-Metalls Cer (chemisches Symbol Ce), das der Lanthanoiden-Gruppe zugehört. Technisches Cerdioxid liegt allgemein als mikro- oder nanoskaliges weißes bis schwach gelbliches Pulver vor [1].
Anwendung findet Cerdioxid als Antireflexbeschichtung für Infrarotfilter und beim Bau von Farbfernsehröhren eingesetzt. Zusammen mit Cobalt dient es der Fertigung leistungsfähiger Magnete. Da Cerdioxid bei Erwärmung stark leuchtet, wird es in Kombination mit anderen Seltenerdmetalloxiden in Glühstrümpfen verwendet, die die Lichtausbeute von Gaslampen deutlich verbessern. Zudem wird Cerdioxid traditionsgemäß beim Schleifen und Polieren von Gläsern eingesetzt, z.B. bei der Fertigung von Flachbildschirmen bzw. von Linsen für Handy-Kameras oder die Laseroptik von CD-Spielern.
Ein großer Markt für nanoskaliges CeO2 ist das Reinigen und Polieren von Silicium-Wafern, wie sie in großen Mengen in der Elektronikindustrie für hochmoderne Chipsysteme oder für Solarzellen benötigt werden. CeO2 reagiert mit dem zu bearbeitenden Material, so dass es extrem fein dosiert abgetragen werden kann. Es ermöglicht so die Herstellung ultra-glatter Oberflächen, die die Voraussetzung für die Miniaturiserung von Schaltkreisen darstellt. CeO2 stellt zusammen mit Aluminiumoxid das Material der Wahl beim chemisch-mechanischen Polieren (CMP) dar [2].
Nanoskaliges Cerdioxid wird zudem u. a. in Abgaskatalysatoren von Kraftfahrzeugen eingesetzt. Hier dient es dazu, eine Sauerstoff-Speicherfunktion zur Verfügung zu stellen. Es oxidiert Kohlenstoffmonoxid und überschüssige Kohlenwasserstoffe auch dann noch zu CO2, wenn im Abgasgemisch kurzzeitig Sauerstoffmangel auftritt. Dabei wird CeO2 zu Ce2O3 reduziert, das später wieder zurück oxidiert wird, sobald wieder genügend Sauerstoff im Abgas vorhanden ist. Neben dem Einsatz in Abgaskatalysatoren, wo es gegenüber dem deutlich aktiveren, jedoch auch teureren, Platin nur eine Unterstützerrolle einnimmt, ist auch eine unmittelbare Zugabe zum Kraftstoff vorgesehen. Die Cerdioxid-Nanopartikel sollen zu einer Verminderung des Verbrauchs sowie der Rußpartikelemission von Dieselmotoren führen [3,4,5].
In Brennstoffzellen werden mit weiteren Seltenerdmetalloxiden beschichtete CeO2-Nanopartikel eingesetzt um die Sauerstoffionenleitfähigkeit zu verbessern und somit niedrigere Betriebstemperaturen zu ermöglichen.
Ebenso stellt Nano-CeO2 einen idealen UV-Absorber dar und wird deshalb als Additiv in Lacken und Beschichtungen für Holzschutzanwendungen verwandt, um deren UV-Stabilität zu steigern.
Cerdioxid ist als nanometergroßes Pulver nicht selbstentzündlich. Auch als fein verteilte Mischung mit Luft (Staub) unter Einwirkung einer Zündquelle ist Cerdioxid nicht entzündlich, also besteht keine Möglichkeit einer Staubexplosion.
Natürliches Vorkommen und Herstellung
Cer, nach dem Planeten Ceres benannt, kommt in der Natur relativ häufig in Mineralien wie Cerit, Monazit oder Bastnäsit vor. Mit Sauerstoff setzt es sich leicht zu Cerdioxid (CeO2) um. Neben CeO2 bildet Cer die Oxide Ce2O3 und C3O4[1]. Cerdioxid wird gewöhnlich durch Oxidation von Cerhydroxiden oder Cercarbonaten hergestellt.
NanoCare - Datenblätter
- Ceroxid Datenblatt Nr.1 (PDF)
- Ceroxid Datenblatt Nr.2 (PDF)
- Ceroxid Datenblatt Nr.3 (PDF)
- Ceroxid Datenblatt Nr.4 (PDF)
- Ceroxid Datenblatt Nr.5 (PDF)
Literatur
- Römpps Chemie-Lexikon, Band 1, 8. Aufl. 1979, Franckh’sche Verlagshandlung, W. Keller & Co, ISBN 3-440-04511-0.
- Technology Review (2006). Wenn Diesel auf Nanopartikel trifft. Peter Fairley, 13.09.06. (Stand letzter Zugang: Aug 2018)
- Gutsch, A et al. (2005), Chemie Ingenieur Technik, 77(9): 1377-1392.
- Sajith, V et al. (2010), Adv Mech Eng, 2010 1-6.
- Selvan, V et al. (2009), ARPN Journal of Engineering & Applied Sciences, 4(7). (PDF ).
Cerdioxid kommt in verschiedenen Anwendungen zum Einsatz, z.B. in Brennstoffzellen, Holzschutzmitteln, Lacken oder Schleif- und Poliermitteln.
Allgemeine Gefährdung
Je nach Zelltyp lösen Cerdioxid Nanopartikel unterschiedliche Reaktionen aus. Nur wenige Studien zeigen eine toxische Wirkung der Nanopartikel, in den meisten Fällen schützen es die Zellen.
Literatur
- Li, Y et al. (2016), Environ Toxicol Pharmacol, 44: 25-29.
Untersuchungen am lebenden Organismus - in vivo
Das Projekt NanoCare untersuchte in Kurzzeitinhalationsstudien (über sechs Stunden täglich, für fünf Tage) mit Ratten den Effekt von Cerdioxid Nanopartikeln. Dabei wurden die eingeatmeten Partikel in der Lunge und in lungenassoziierten Lymphknoten wieder gefunden. Weder die Leber, noch Nieren, Milz oder das Hirn mit anhängendem Riechnerv wiesen Partikel auf [1]. Anschließende Untersuchungen der Lungenflüssigkeit nach Exposition mit Cerdioxid zeigten, dass Entzündungsmarker auftraten und mit der verabreichten Dosis an Partikeln zunahmen.
Werden Cerdioxid Nanopartikel Tieren über das Futter oder das Blut verabreicht, lagern sich die Nanopartikel in verschiedenen Organen wie Herz oder Leber ab. Durch das Abfangen von Radikalen hatten die Cerdioxid Nanopartikel eine schützende Wirkung für Nervenzellen [2].
Literatur
- NanoCare 2009, Final Scientific Report, ISBN 978-3-89746-108-6. (PDF-Dokument, 19 MB ).
- Hirst, S.M. et. al. (2013), Environ Toxicol, 28(2): 107-118.
Untersuchungen außerhalb des Organismus - in vitro
Verschiedene in vitro-Studien der letzten Jahre mit nanoskaligen Cerdioxid Nanopartikeln zeigen, dass dieses Metalloxid je nach verwendeter Zelllinie unterschiedliche Reaktionen in den Zellen auslösen kann. In humanen Lungenepithelzellen (BEAS-2B), die in vitro mit verschiedenen Metalloxid-Nanopartikeln behandelt wurden, sind reine Metalloxide wahrscheinlich nicht in der Lage, Entzündungsfaktoren zu induzieren. In der humanen Lungenepithelzelllinie A549 nahm die Zellvitalität dagegen mit zunehmender Partikelkonzentration ab, wohingegen eine andere Studie keine zytotoxischen Reaktionen durch nano-CeO2 nachweisen konnte. In der menschlichen Immunzellinie Jurkat wirkt nanoskaliges Cerdioxid ebenfalls nicht-toxisch, sondern schützt die Zellen vor schädlichem UV-Licht. Den gleichen Schutzmechanismus zeigte auch eine Studie mit verschiedenen Lungenzellen der Ratte. Auch hier wirken Cerdioxid Nanopartikel als Antioxidans und reduzieren die ROS-Produktion [1-7].
Nur wenige Studien konnten bisher beobachten, dass CeO2 toxisch für Zellen ist. Meist ist dabei oxidativer Stress im Spiel, der dann zum Absterben der Zellen führen kann. Allerdings sind die Arbeiten, die genau das Gegenteil zeigen, in der Überzahl. So wird häufig beobachtet, dass Cerdioxid die Bildung von Sauerstoffradikalen hemmt und damit die Zellen schützt. Im Projekt NanoCare wurde mittels in vitro–Versuchen mit der humanen Lungenepithelzelllinie A549 eine relativ hohe Schwellenkonzentration bestimmt. Erst ab dieser Konzentration (der niedrigsten Konzentration, die einen Effekt erzeugt) wurde beobachtet, dass die Zellen in Stress versetzt werden und Entzündungsmarker und reaktive Sauerstoffspezies (ROS) produziert wurden. Wurden niedrigere Dosen an CeO2 verwendet, konnten bei verschiedenen Zelllinien keine Effekte mehr ausgelöst werden [9]. Dies wurde auch in einer neueren Arbeit bestätigt, die eine Übersicht zu den aktuellen Studien zu verschiedenen Nanomaterialien gibt. Zu Cerdioxid wird hier angemerkt, dass die Größe nicht sehr entscheidend für einen Effekt ist. Außerdem ist die Toxizität sehr niedrig, was wohl auch durch die Schutzwirkung beeinflusst wird, die das Cerdioxid gegenüber Sauerstoffradikalen bietet [1,2,4,6-9].
Ergänzend zu einfachen Kultursystemen mit nur einer Zelllinie, wurden im Projekt NanoCare auch komplexe sog. Ko-Kultursysteme verwendet [9]. Mit Hilfe solcher Tests kann die in vivo Situation im Körper besser dargestellt werden, weil das Zusammenspiel der Zellen simuliert wird. In solchen Systemen konnte gezeigt werden, dass die Ko-Kultur sensitiver auf CeO2 reagiert als die Monokulturen an sich. Das zeigt, dass eine Kommunikation zwischen verschiedenen Zellen stattfindet, die u.U. solche Effekte verstärken kann.
Literatur
- Mittal, S. & Pandey, A.K.(2014), Biomed Res Int, 2014891934.
- Simko, M. et. al. (2015), Int J Mol Sci, 16(11): 25954.
- Veranth, J.M. et. al. (2007), Part Fibre Toxicol, 42.
- Lin, W. et. al. (2006), Int J Toxicol, 25(6): 451-457.
- Park, B et al. (2008), Inhal Toxicol, 20(6): 547-566.
- Caputo, F. et. al. (2015), Nanoscale, 7(38): 15643-15656.
- Dunnick, K.M. et. al. (2015), Biol Trace Elem Res, 166(1): 96-107.
- Hirst, S.M. et. al. (2013), Environ Toxicol, 28(2): 107-118.
- Nanocare (2009). Report:"Final Scientific Report", Dechema e.V., Frankfurt a.Main. ISBN:978-3-89746-108-6 (PDF, 19 MB ).
Tatsächlich auftretende Umweltkonzentrationen von Cerdioxid Nanopartikeln sind aktuell nicht bekannt. Derzeit können die zu erwartenden Umweltkonzentrationen (sog. PEC-Wert) an nanoskaligem Cerdioxid unter Verwendung spezifischer Computermodelle vorhergesagt werden.

Abfließendes Regenwasser © Mr. Twister / fotolia.com
Geschätzt werden pro Jahr ungefähr 1000 - 1500 Tonnen Cerdioxid Nanopartikel (CeO2) freigesetzt, was weit unter den Werten anderer Nanomaterialien, wie beispielsweise Titandioxid mit 38000 Tonnen pro Jahr, liegt. Cerdioxid in Nanoform wird oft in geschlossenen Systemen z.B. zum Polieren von Halbleiterplatten verwendet, so dass hier keine Freisetzung in die Umwelt stattfindet.
Erwartungsgemäß sollte der größte Teil der aus Produkten freigesetzten Cerdioxid Nanopartikel in Böden und Mülldeponien zu finden sein. Aus Konsumgütern oder Dieselabgasen, die Cerdioxid Nanopartikel enthalten, gelangen schätzungsweise 0,0001 µg/L ins Wasser und 0,01 µg/kg in den Boden. Für z.B. Dieselabgase wird ein Auswaschen der Partikel aus der Luft durch Regen angenommen. In Großbritannien wurden für Böden neben großen Hauptstraßen Nano Cerdioxid -Werte von 0,016 µg/kg vorhergesagt. Durch das Abspülen der Straßenoberfläche kann das Wasser bis zu 0,3 μg/L Cerdioxid Nanopartikel enthalten [1-4].
Generell sind im Vergleich zu anderen Nanomaterialien wie Titandioxid, Fullerene, Zinkoxid und vielen anderen Chemikalien die erwarteten Umweltkonzentrationen für Cerdioxid Nanopartikel sehr gering.
Literatur
- Keller, AA et al. (2013), J Nanopart Res, 15(6).
- Tiede, K et al. (2009), J Chromatogr A, 1216(3): 503-509.
- Boxall ABA et al. (2008), Report: "Targeted monitoring for human pharmaceuticals in vulnerable source and final waters", Drinking Water Inspectorate Project No. WD0805. Ref DWI 70/2/231 (PDF )
- Johnson, AC et al. (2012), Environ Toxicol Chem, 31(11): 2582-2587.
Studien zeigen, dass Cerdioxid Nanopartikel in den Körper gelangen können. Sie können einerseits Entzündungsprozesse auslösen, andererseits eine schützende Wirkung für den Körper haben.
Aufnahme über die Lunge - Inhalation
Werden Partikel eingeatmet, können diese in der Lunge, aber auch in anderen Organen nachgewiesen werden, allerdings nur in sehr kleinen Mengen (vgl. Körperbarrieren - Nanopartikel und die Lunge). Der Großteil der Cerdioxid Nanopartikel verbleibt in der Lunge, nur etwa ein Promille der ursprünglich verabreichten Menge an Nanopartikeln waren nach 28 Tagen in Leber, Milz und Nieren der Versuchstiere zu finden. Das sind sehr kleine Mengen, die toxikologisch keine Rolle spielen. Die Größe der untersuchten Partikel hatte in diesen Studien keinen Einfluss auf die Aufnahme und Verteilung der Nanopartikel im Körper [1,2,3].
Auch die Form des nanoskaligen Cerdioxids hat einen Einfluss auf die ausgelösten Effekte. Bei einer vergleichenden Studie mit kugel- und stäbchenförmigen Cerdioxid Nanopartikeln in Mäusen verursachten nur die sehr langen Stäbchen mit mehr als einem Mikrometer Länge eine anhaltende Entzündungsreaktion in der Lunge. Zwar riefen die kürzeren Stäbchen (Länge < 1 µm) wie auch die kugelförmigen Cerdioxid Nanopartikeln eine entzündliche Wirkung hervor, welche aber nach kurzer Zeit wieder aufgelöst wurde [4]. Die Forscher selbst haben Ihre Studie wie folgt eingeschätzt: „Wenn man diese Ergebnisse zum Cerdioxid mit anderen Metalloxid Nanopartikeln vergleicht, dann ist Cerdioxid wirklich wenig giftig. ....“
Studien an Versuchstieren haben gezeigt, dass über die Lunge eingeatmete Cerdioxid Nanopartikel hauptsächlich in der Lunge verbleiben und je nach Form und Menge dort Entzündungsreaktionen verursachen können. Ergebnisse zu möglichen Langzeiteffekten von Cerdioxid Nanopartikeln aus einer aktuellen Langzeit-Tierstudie unter subchronischen Expositionsbedingungen werden für 2018 erwartet.
Literatur
- NanoCare (2009). Report:"Final Scientific Report", Dechema e.V., Frankfurt a.Main. ISBN:978-3-89746-108-6. (PDF-Dokument, 19 MB ).
- Geraets, L. et. al. (2012), Toxicol Sci, 127(2): 463-473.
- He, X et al. (2010), Nanotechnology, 21: 285103
- Lin,S. et. al. (2014), ACS Nano, 8(5): 4450-4464
Aufnahme über die Haut - Dermal

©vimarovi / fotolia.com
Eine Aufnahme von Cerdioxid Nanopartikel über die Haut betrifft hauptsächlich kosmetische oder pharmazeutische Produkte, wie z.B. Sonnencremes. Da Cerdioxid neben seiner Funktion als anorganischer (auch mineralisch genannt) UV-Filter zusätzliche antioxidative Eigenschaften besitzt, wird es bereits als neuer UV-Filter in Sonnenschutzcremes untersucht. Bisher gibt es noch keine Produkte auf dem Markt [1].
Literatur
- Caputo, F. et. al. (2015), Nanoscale, 7(38): 15643-15656.
Aufnahme über den Magen-Darm-Trakt

© ag visuell / Fotolia.com
In den vergangenen Jahren wurden verschiedene Experimente zur Aufnahme von Cerdioxid über den Magen durchgeführt. Diese sollte zeigen, ob das Material im Organismus schädigende Effekte verursachen könnte, sollte es über die Nahrung in unseren Körper gelangen. Die meisten der Studien fanden keine gesundheitlich relevanten Folgen einer solchen Behandlung. Sehr genaue Analysen konnten dabei mit radioaktiv markiertem Cerdioxid gemacht werden, das im Körper sehr leicht nachzuweisen ist. Sehr kleine CeO2 Partikel mit einem Durchmesser von nur 7 nm wurden überhaupt nicht vom Darmepithel aufgenommen. 90% der verabreichten Partikel verließen den Körper über den Stuhl bereits nach einem Tag, der Rest folgte innerhalb der nächsten zwei Tage, so dass nach drei Tagen praktisch alles wieder ausgeschieden worden war. Wenn das Cerdioxid stark überdosiert wurde, konnte nur eine extrem kleine Menge von 10 Milliardstel im Blut nachgewiesen werden [1, 2].
Durch Versuche mittels intravenöser Injektion konnte gezeigt werden, dass sich direkt in den Körper gegebenes Cerdioxid in der Leber und der Milz anreichert, während in Gehirn und Herz keine Partikel nachweisbar sind. Das injizierte Cerdioxid konnte wie auch schon das über das Futter verabreichte die schädliche Wirkung eines Lebergiftes vermindern, hatte selbst jedoch keine negativen Folgen für das Tier.
Interessant ist das Ergebnis einer weiteren Untersuchung in Fischen, bei der verschiedene Formen der Nanopartikel aus Cerdioxid in ihrer Wirkung verglichen wurden. Das Resultat war auch hier eindeutig, die runden Nanopartikel lösten keine gefährdenden Effekte aus, während die längsten untersuchten Stäbchen durchaus in der Lage waren, eine Entzündungsreaktion hervorzurufen [3].
Eine Studie in Ratten hat im Gegensatz zu den anderen Studien durchaus eine Reaktion in den Tieren gefunden. Verabreichung relativ großer Mengen im akut-toxischen Test haben eine sehr leichte DNA-schädigende Wirkung gezeigt, jedoch nur in den höchsten Dosierungen von 1000 mg/kg Körpergewicht und diese ging nach 48 Stunden Behandlung auch wieder zurück. In der Vergleichsstudie mit wiederholter Verabreichung über 28 Tage waren deutlichere Effekte zu erkennen, allerdings auch hier nur bei den hohen Dosierungen [4,5].
Literatur
- He, X. et. al. (2010), Nanotechnology, 21(28): 285103
- Hirst, S.M. et. al. (2013), Environ Toxicol, 28(2): 107-118
- Lin, S . et. al. (2014), ACS Nano, 8(5): 4450-4464
- Kumari, M. et. al. (2014a), Mutat Res, 775-7767-19
- Kumari, M. et. al. (2014b), Mutagenesis, 29(6): 467-479
In früheren Studien zeigten Cerdioxid Nanopartikel toxische Effekte für Umweltorganismen. Eine größenabhängige Toxizität von Cerdioxid Nanopartikeln, bei der kleinere Teilchen stärkere Effekte in Organismen auslösen, wird gelegentlich beobachtet.

Mikroorganismen zeigen unterschiedliche Reaktionen gegenüber Cerdioxid Nanopartikel (CeO2). Nanoskaliges Cerdioxid ist nicht toxisch für Hefen oder Bakterien, die im Klärschlamm vorkommen. Im Gegensatz dazu werden andere Bakterienstämme, z.B. aus der Biogasproduktion oder auch Bodenbakterien, die mit Pflanzen vergesellschaftet sind, in ihrem Wachstum gehemmt. Der Mechanismus hinter der Partikel-vermittelten Toxizität ist bislang noch nicht vollständig geklärt [7,8,11-19].
In Abhängigkeit von der Größe stören Cerdioxid Nanopartikel das Wachstum und die Stoffwechselaktivität von Algen, was entweder auf eine Beschädigung der Zellwand durch die Nanopartikel oder eine Beeinträchtigung der Nährstoffaufnahme zurückzuführen ist. Über eine Oberflächenbeschichtung der Cerdioxid Nanopartikel mit Polymeren lassen sich die toxischen Effekte minimieren. Gleichermaßen behindert die Bindung der Nanopartikel an natürliches organisches Material deren Anlagerung an die Algen-Zelloberfläche und dadurch auch die toxischen Auswirkungen [3,11,17,19-27].

Die Sterblichkeit oder Beweglichkeit von Wasserflöhen wird nicht durch Cerdioxid Nanopartikel beeinflusst, allerdings treten Art-spezifisch Unterschiede in der Empfindlichkeit auf. Im Allgemeinen haften Cerdioxid Nanopartikel an der äußeren Oberfläche der Tiere an bzw. werden über den Verdauungstrakt aufgenommen. Über mehrfaches Häuten der Wasserflöhe im Verlauf der Entwicklung können die angelagerten Nanopartikel jedoch wieder von der Haut entfernt werden. Eine chronische Exposition mit nanoskaligem Cerdioxid über 21 Tage führte zu einer erhöhten Sterblichkeit und damit einer reduzierten Überlebensrate der Wasserflöhe. Dieser Effekt wird indirekt durch die Partikel verursacht, da ihre Anwesenheit im Darm die Nahrungsaufnahme einschränkt [2,3,7-10]. Salzkrebse werden von umweltrelevanten Konzentrationen (PEC Wert) an Cerdioxid Nanopartikeln nicht beeinflusst [28].
Umweltrelevanten Konzentrationen von Cerdioxid Nanopartikeln sind nicht toxisch für Miesmuscheln, da die Partikel nach der Aufnahme effektiv ausgeschieden werden. Jedoch zeigten einige Studien Hinweise für Veränderungen in den Verdauungsdrüsen, der Blutzusammensetzung sowie Immunzellen in Miesmuscheln und Seeigeln [29-31].
 Nanoskaliges Cerdioxid verursacht bei Rundwürmern (Nematoden) oxidative Schäden, verzögert das Wachstum während der Entwicklung und sorgt so letztlich für eine reduzierte Lebenserwartung. Eine Beschichtung der Cerdioxid Nanopartikel mit positiv geladenen Materialien erhöht deren Aufnahme in den Körper und dadurch auch die toxischen Effekte. Bei Regenwürmern wurden nach der Exposition mit Cerdioxid Nanopartikel Veränderungen im Darm und Hautgewebe beobachtet. Huminsäuren, die überall im Boden vorhanden sind, können jedoch die Toxizität verringern [32-35].
Nanoskaliges Cerdioxid verursacht bei Rundwürmern (Nematoden) oxidative Schäden, verzögert das Wachstum während der Entwicklung und sorgt so letztlich für eine reduzierte Lebenserwartung. Eine Beschichtung der Cerdioxid Nanopartikel mit positiv geladenen Materialien erhöht deren Aufnahme in den Körper und dadurch auch die toxischen Effekte. Bei Regenwürmern wurden nach der Exposition mit Cerdioxid Nanopartikel Veränderungen im Darm und Hautgewebe beobachtet. Huminsäuren, die überall im Boden vorhanden sind, können jedoch die Toxizität verringern [32-35].

Cerdioxid Nanopartikel werden nachweislich aus dem Wasser in die Leber des Zebrafischs aufgenommen. Über die Nahrung aufgenommenes nanoskaliges Cerdioxid verringert nicht nur das Wachstum der Fische sondern stört auch verschiedene Körperfunktionen von Zebrafisch und Goldfisch. Weder bei Leberzellen der Regenbogenforelle noch bei Embryonen des Zebrafischs traten schädliche Wirkungen nach Exposition mit nanoskaligem Cerdioxid auf. Alle in Fischen beobachteten toxischen Effekte der Cerdioxid Nanopartikel traten unabhängig von der jeweiligen Partikelgröße auf [1-7].
 Die Auswirkungen von Cerdioxid Nanopartikel auf Pflanzen lassen sich über Parameter wie Keimung, Wurzelwachstum und Fruchtwachstum bestimmen. Viele Pflanzen nehmen die Cerdioxid Nanopartikel in Wurzeln und Triebe auf. Zwar verläuft die Keimung bei den meisten Pflanzen trotz Partikeleinlagerung normal, das Wurzelwachstum nimmt jedoch zu. In einigen Pflanzen führt die Exposition mit Cerdioxid Nanopartikel zu einer Verringerung der Fruchtanzahl und auch die Zusammensetzung von Pflanzen (z. B. von Samen bezüglich Fett- oder Proteingehalt) wird beeinflusst. Dies lässt sich wahrscheinlich auf eine veränderte Aktivität verschiedener Stoffwechselenzyme zurückführen. Auch können Cerdioxid Nanopartikel über eine natürliche Nahrungskette von der Pflanze (z.B. Zucchini) zu verschiedenen Tieren (Grille, Spinne) weitergegeben und angereichert werden [36-51].
Die Auswirkungen von Cerdioxid Nanopartikel auf Pflanzen lassen sich über Parameter wie Keimung, Wurzelwachstum und Fruchtwachstum bestimmen. Viele Pflanzen nehmen die Cerdioxid Nanopartikel in Wurzeln und Triebe auf. Zwar verläuft die Keimung bei den meisten Pflanzen trotz Partikeleinlagerung normal, das Wurzelwachstum nimmt jedoch zu. In einigen Pflanzen führt die Exposition mit Cerdioxid Nanopartikel zu einer Verringerung der Fruchtanzahl und auch die Zusammensetzung von Pflanzen (z. B. von Samen bezüglich Fett- oder Proteingehalt) wird beeinflusst. Dies lässt sich wahrscheinlich auf eine veränderte Aktivität verschiedener Stoffwechselenzyme zurückführen. Auch können Cerdioxid Nanopartikel über eine natürliche Nahrungskette von der Pflanze (z.B. Zucchini) zu verschiedenen Tieren (Grille, Spinne) weitergegeben und angereichert werden [36-51].
Cerdioxid ist gemäß den geltenden europäischen Rechtsvorschriften als potentiell chronisch schädlich für Krebstiere und möglicherweise chronisch giftig für Algen eingestuft, wobei Cerdioxid Nanopartikel insgesamt als nicht sehr giftig erkannt wurden [52].
Abschließend wird die Toxizität von Cerdioxid Nanopartikeln gegenüber Umwelt-Testorganismen als gering eingeschätzt. In einigen Fällen war eine verstärkte Anlagerung von Cerdioxid Nanopartikeln an der Oberfläche der Organismen zu beobachten, welche möglicherweise zu einigen negativen Effekten führen kann.
Literatur
- Johnston, BD et al. (2010), Environ Sci Technol, 44(3): 1144-1151.
- Gaiser, BK et al. (2009), Environ Health, 8 Suppl 1(Suppl 1): S2.
- Van Hoecke, K et al. (2009), Environ Sci Technol, 43(12): 4537-4546.
- Jemec A et al (2015), Sci Total Environ, 506-507: 272-278.
- Lin S et al. (2014), ACS Nano, 8 (5): 4450-4464.
- Xia J et al. (2013), Biomed. Environ Sci, 26 (9): 742-749.
- Park, B et al. (2007), Part Fibre Toxicol, 4(1): 12.
- Auffan M et al. (2013), Water Res, 47: 3921-3930.
- Artells E et al. (2013), PLoS ONE, 8 (8): e71260.
- Thill, A et al. (2006), Environ Sci Technol, 40(19): 6151-6156.
- Limbach, LK et al. (2008), Environ Sci Technol, 42(15): 5828-5833.
- Garcia-Saucedo C et al. (2011), J Hazard Mater 192: 1572-1579.
- Zeyons, O et al. (2009), Nanotoxicology, 3(4): 284-295.
- Garcia A et al. (2012), J Hazard Mater, 199-200: 64-72.
- Antisari LV et al. (2013), Soil Biol Biochem, 60: 87-94.
- Bandyopadhyay S et al. (2012), J Hazard Mater, 241-242: 379-386.
- Shah V et al. (2012), PLoS ONE, 7 (10): e47827.
- Rodea-Palomares I et al. (2012), Aqua Toxicol, 122-123: 133-143.
- Röhder LA et al. (2014), Aqua Toxicol, 152: 121-130.
- Taylor NS et al. (2016), Nanotoxicology, 10(1): 32-41.
- Rodea-Palomares I et al. (2011) Toxicol Sci, 119 (1): 135-145.
- Manier N et al (2013), Environ Pollut, 180: 63-70.
- Booth A et al. (2015), Sci Total Environ, 505: 596-605.
- Van Hoecke K et al. (2011), Environ Pollut, 159: 970-976.
- Angel BM et al (2015), Aquat Toxicol, 168: 90–97.
- Rogers, NJ et al. (2010), Environ Chem, 7(1): 50-60.
- Conway JR et al. (2014), Environ Sci Technol, 48: 1517-1524.
- Gambardella C et al. (2014), Environ Monit Assess, 186: 4249-4259.
- Garaud M et al. (2015), Aqua Toxicol, 158: 63-74.
- Falugi C et al. (2012), Marine Environ Res, 76: 114–121.
- Zang H et al. (2011), Environ Sci Technol, 45: 3725-3730.
- Arnold MC et al. (2013), Arch Environ Contam Toxicol, 65: 224-233.
- Lahive E et al. (2014), Environ Chem, 11: 268-278.
- Collin B et al. (2013), Environ Sci Technol, 48: 1280-1289.
- Lopez-Moreno, ML et al. (2010), Environ Sci Technol, 44(19): 7315-7320.
- Zhao L et al. (2012), J Hazard Mater, 225-226: 131-138.
- Hernandez-Viezcas JA et al. (2013), ACS Nano, 7 (2): 1415-1423.
- Majumdar S et al. (2014), J Hazard Mater, 278: 279-287.
- Morales MI et al. (2013), J Agric Food Chem, 61: 6224-6230.
- Rico CM et al. (2013), J Agric Food Chem, 61: 11278-11285.
- Trujillo-Reyes J et al. (2013), J Hazard Mater, 263: 677-684.
- Rico CM et al. (2015), Appl Spectrosc, 69 (2): 287-295.
- Zhao L et al. (2015), Environ Sci Technol, 49: 2921-2928.
- Schwabe F et al. (2013), Chemosphere, 91: 512-520.
- Rico CM et al. (2014), J Agric Food Chem, 62: 9669-9675.
- Rico CM et al. (2015),Environ Sci Pollut Res, 22: 10551-10558.
- Corral-Diaz B (2014), Plant. Physiol Biochem, 84: 277-285.
- Zhang P et al. (2013), Nanotoxicology, 9 (1): 1-8.
- Rico CM et al. (2013), Environ Sci Technol, 47: 5635-5642.
- Tumburu L et al (2015), Environ Toxicol Chem, 34 (1): 70-83.
- Hawthorne J et al (2014), Environ Sci Technol 48:13102-13109.
- Juganson K et al (2015), Beilstein J Nanotechnol, 6: 1788-1804.
In früheren Studien zeigten Cerdioxid Nanopartikel toxische Effekte für Umweltorganismen. Eine größenabhängige Toxizität von Cerdioxid Nanopartikeln, bei der kleinere Teilchen stärkere Effekte in Organismen auslösen, wird gelegentlich beobachtet.
Intravenöse Zugabe und Verteilung im Körper
Nur wenige Studien existieren, die Cerdioxid nach intravenöser Injektion untersucht haben [1-4]. Auch wenn das Cerdioxid direkt in den Körper verabreicht wird, wird es großenteils wieder über den Stuhl ausgeschieden. Allerdings verbleibt weit mehr im Körper, als bei einer vergleichbaren Verabreichung über das Futter. Cerdioxid wird, wie alle anderen Fremdstoffe auch, zumeist in der Leber und in der Milz wieder gefunden, dies gilt für alle Studien, die hier aufgeführt wurden [1-4]. Nur wenig wurde in der Niere oder der Lunge gefunden, unter der Nachweisschwelle war das Cerdioxid im Gehirn und im Herz. In einer der Studien konnte ein interessanter Befund festgestellt werden, eine Behandlung mit dem Lebergift Tetrachlorkohlenstoff (CCl4) und Cerdioxid zeigte, dass das Cerdioxid eine schützende Wirkung besitzen kann, indem es die oxidativen Schäden durch das CCl4 durch seine anti-oxidative Wirkung erheblich reduzieren konnte. Hier zeigte sich also eher ein positiver Effekt durch die Cerdioxid Nanopartikel [1].
In den anderen Studien konnte sowohl für kleine (5 nm) [2, 3] als auch für größere (30 nm) Nanopartikel [4] ein oxidativer Schaden in der Leber und teilweise auch in anderen Organen beobachtet werden. Dieser war zwar nicht besorgniserregend, aber deutlich vorhanden. Es muss hier aber deutlich darauf hingewiesen werden, dass im Gegensatz zur Studie von Hirst und Kollegen [1], die eine Gesamtdosis von 0,5 mg/kg Körpergewicht verabreicht haben, die anderen drei Studien mit Konzentrationen von 85 – 100 mg/kg Körpergewicht enorm hohe Dosierungen eingesetzt haben. Daher verwundert es nicht, dass bei einer solch hohen Belastung der Leber durch direkte Injektion des Materials in den Blutkreislauf auch negative Effekte auftreten konnten.
Literatur
- Hirst, S.M. et. al. (2013), Environ Toxicol, 28(2): 107-118
- Hardas, S.S. et. al. (2012), Neurotoxicology, 33(5): 1147-1155
- Tseng, M.T. et al. (2012), Toxicol. Appl. Pharmacol., 260(2): 173-182
- Yokel, R.A. et. al. (2012), Toxicol Sci, 127(1): 256-268
Verhalten an der Blut-Hirn-Schranke
Cerdioxid-Partikel gelangen nicht ins Gehirn, nachdem diese Partikel eingeatmet wurden [1]. Dieser Befund wird durch zwei weitere unabhängige Studien belegt, die in den USA mit zwei verschiedenen Cerdioxidpartikeln durchgeführt wurden [2, 3]. Sehr kleine 5 nm und größere 30 nm Partikel wurden Ratten in einer relativ hohen Dosierung in das Blutgefäßsystem injiziert, um die Verteilung im Organismus direkt zu untersuchen. Dabei wurden weder die sehr kleinen noch die 30 nm großen Nanopartikel im Gehirn nachgewiesen. Wie üblich für solche Expositionen wurde der Hauptanteil in der Leber, gefolgt von Milz und Niere, gefunden (siehe auch Körperbarrieren – Nanopartikel an der Blut-Hirn Schranke)
Literatur
- NanoCare 2009, Final Scientific Report, ISBN 978-3-89746-108-6. (PDF-Dokument, 19 MB ).
- Hardas, S.S. et. al. (2012), Neurotoxicology, 33(5): 1147-1155.
- Yokel, R.A. et. al. (2012), Toxicol Sci, 127(1): 256-268.
Aufnahmeverhalten in Zellen
In einer Studie wurde die Aufnahme von Cerdioxid Nanopartikeln mit einer Größe zwischen 20 und 50 nm in menschlichen Lungenzellen nachgewiesen. Nach der Aufnahme befanden sich die Partikel in Vesikeln im Cytoplasma der Zellen in verklumpter Form. Weder außerhalb der Vesikel noch in anderen Zellbestandteilen wurden Nanopartikel gefunden [1].
Literatur
- Limbach, LK et al. (2005), Environ Sci Technol, 39(23): 9370-9376.
Über das Umweltverhalten von Cerdioxid Nanopartikel gibt es derzeit nur wenige Informationen. Die Nanopartikel unterliegen unterschiedlichen Transport- und Transformationsprozessen, die deren Verhalten in Wasser, Boden und Luft maßgeblich beeinflussen.
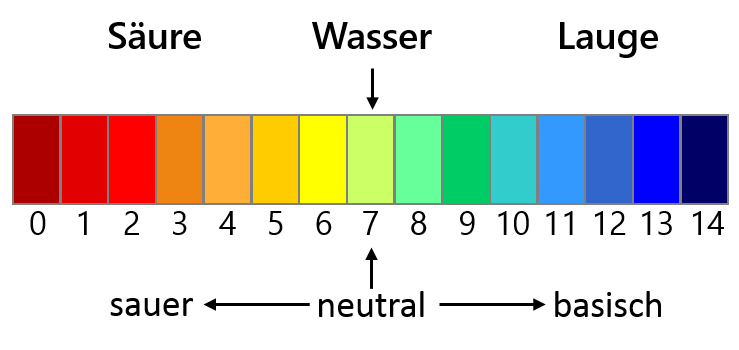
pH Skala (c) DaNa Team
Unter den vorherrschenden Bedingungen in natürlichen Gewässern setzen Cerdioxid Nanopartikel (CeO2) keine Ionen frei. Allerdings hängt die Löslichkeit sowie die Beweglichkeit der Cerdioxid Nanopartikel vom pH-Wert der jeweiligen Umgebung ab. Saure Bedingungen (pH-Werte unter 5), wie sie in einigen natürlichen Gewässern und auch im sauren Regen auftreten, verstärken drastisch die Ionenfreisetzung. Zudem behindert eine saure Umgebung die Beweglichkeit der Cerdioxid Nanopartikel und fördert dadurch die Wahrscheinlichkeit einer Bindung an andere Materialien.
Im Gegensatz führen neutrale oder basische Bedingungen, welche in den meisten europäischen Gewässern vorherrschen, zu einer guten Beweglichkeit der Nanopartikel und der Transport wird durch natürliche organische Stoffe gefördert [1-3].
Im Boden wird die Beweglichkeit der Cerdioxid Nanopartikel sowohl durch die Zusammensetzung des Bodens als auch durch die Beschichtung der Nanopartikel beeinflusst. Die Cerdioxid Nanopartikel binden bevorzugt an Phosphate (z. B. Komponenten des Düngemittels), was deren Beweglichkeit erhöht [4,5].

Kläranlage von oben © MariuszSzczygie / fotolia.com
In einer Laborstudie wurde eine Modellkläranlage eingesetzt, um mittels konventioneller Abwasserbehandlungsverfahren die Entfernung von Metalloxid Nanopartikel aus dem Abwasser zu untersuchen. In den meisten Fällen wurden die Nanopartikel durch direkte Bindung an den Klärschlamm wirksam aus dem Abwasser entfernt. In diesem Modellversuch verbleiben nur 6 % der ursprünglichen Cerdioxid Nanopartikel im Abwasser und werden aus der Kläranlage ausgeleitet. In Deutschland wird Klärschlamm entweder verbrannt und verbleibt in der Asche oder wird auf landwirtschaftlich genutzten Flächen ausgebracht. Davon ausgehend sollte sich der Hauptanteil an nanoskaligem Cerdioxid im Boden ablagern (vgl. Abschnitt Freisetzung in die Umwelt).
Allerdings stellen Nanopartikel Suspensionen mit stabilisierenden Bestandteilen (z.B. Huminsäuren) eine größere Herausforderung für die Abwasserbehandlung dar. Die Nanopartikel sind schwer zu entfernen, da zum einen die stabilisierenden Bestandteile die Bindung der Nanopartikel an die Bakterien im Klärschlamm behindert. Zum anderen helfen unterschiedliche Bestandteile des Abwassers dabei, die Cerdioxid Nanopartikel in Lösung zu halten, so dass die Sedimentation der Nanopartikel gegenüber reinem Wasser verringert ist [6,7].
Derzeit liegen keine Informationen über das Verhalten von Cerdioxid Nanopartikeln nach einer Freisetzung in die Luft vor. Für z.B. Dieselabgase wird ein Auswaschen der Partikel aus der Luft durch Regen angenommen .
Insgesamt setzen Cerdioxid Nanopartikel unter vorherrschenden Umgebungsbedingungen keine Ionen frei. Die Beweglichkeit nicht-veränderter Cerdioxid Nanopartikel in Böden ist gering und aus dem Abwasser lässt sich der Großteil der Nanopartikel mittels konventioneller Abwasserbehandlungsverfahren gut entfernen.
Literatur
- Dahle J et al. (2015), Chemosphere, 119: 1365-1371.
- Li, Z et al. (2011), Water Res, 45: 4409-4418.
- Petosa, AR et al. (2013), Water Res, 47: 5889-5900.
- Cornelis, G et al. (2011), Environ Sci Technol, 45, 2777–2782.
- Quik, JTK et al. (2010), Chemosphere, 81: 711-715.
- Limbach, LK et al. (2008), Environ Sci Technol, 42(15): 5828-5833.
- Dahle J et al. (2015), Chemosphere, 119: 1365-1371.
- Gomez-Rivera F et al. (2012), Bioresour Technol, 108: 300-304.
 >
>